已知两个羟基同时连在同一个碳原子上时结构是不稳定的,它将发生脱水反应,例如:CH3CH(OH)2→CH3CHO +H2O,现有分子式为C9H8O2Br2的物质M,已知E的化学式为C7H5O2Na,A的相对分子质量为46,在一定条件下可发生下列一系列反应: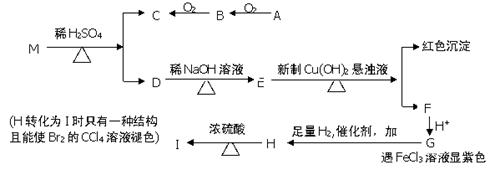
请回答下列问题
(1)B中官能团的名称 ,A的核磁共振氢谱有 个吸收峰;G→H的反应类型 。
(2)M的结构简式
(3)写出下列反应的化学方程式
①E→F ②H→I
(4)同时符合下列条件的G的同分异构体的结构简式有 种,写出其中一种
| A.分子中含有苯环 | B.能发生水解反应 | C.能发生银镜反应 | D.与FeCl3溶液反应显紫色 |
硫酸亚铁晶体(FeSO4·7H2O)在医药上可作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
请回答下列问题:
(1)步骤②加入过量H2O2的目的是。
(2)步骤③中反应的离子方程式为。
(3)步骤④中的一系列操作依次为:过滤、、灼烧、、称量。
(4)若实验无损耗,则每片补血剂含铁元素的质量为g(用含a的代数式表示,不用化简)。
(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。反应原理为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需要的玻璃仪器为;
②上述实验中的KMnO4溶液需要酸化,可用于酸化的酸是。
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
化学是一门以实验为基础的自然科学,进行化学实验时要熟悉中学化学实验中常见仪器及用品,采取正确的实验操作,注意实验安全。
(1)在仪器:a.分液漏斗、b.试剂瓶、c.集气瓶、d.滴定管、e.容量瓶、f.量筒、g.托盘天平中,标有“0”刻度的是(填序号,下同);标有具体使用温度的是。
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺。在下列仪器中,没有用到“磨砂”工艺处理的有。
a.试管
b.分液漏斗
c.带滴管的试剂瓶(滴瓶)
d.集气瓶
e.酸式滴定管
f.碱式滴定管
(3)下列操作所得实验结果比实际数值偏高的是( )
a.用量筒量取8.5 mL液体时,俯视液面读数
b.中和滴定达到终点时,仰视液面读数
c.配制一定物质的量浓度的溶液定容时,仰视溶液液面
(4)在盛放浓硫酸的试剂瓶的标签上印有如图所示的警示标志,说明浓硫酸是一种。
(5)有同学想用下图所示装置以大理石和稀盐酸反应制取CO2,老师指出,这需要太多的稀盐酸,造成浪费,该同学选用了实验室最常用的一种仪器,加在装置上,解决了这个问题。请你把该仪器画在图中合适的位置。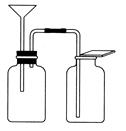
乙基香草醛( )是食品添加剂的增香原料,其香味比香草醛更加浓郁。
)是食品添加剂的增香原料,其香味比香草醛更加浓郁。
(1)乙基香草醛分子中的含氧官能团有乙氧基、(写名称)、(写名称)。核磁共振谱表明该分子中有种不同类型的氢原子。
(2)乙基香草醛的同分异构体A是一种有机酸,A可发生以下变化: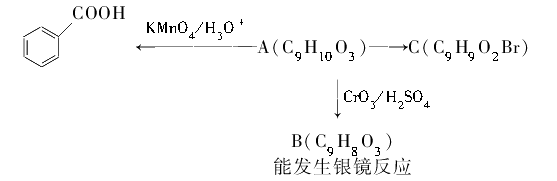 提示:
提示: b.与苯环直接相连的碳原子上有氢时,该碳原子才可被酸性KMnO4溶液氧化为羧基
b.与苯环直接相连的碳原子上有氢时,该碳原子才可被酸性KMnO4溶液氧化为羧基
①写出A的结构简式:。
②写出在加热条件下C与NaOH水溶液发生反应的化学方程式:。
A、B、C、D、E、F和G都是有机化合物,它们的关系如图所示: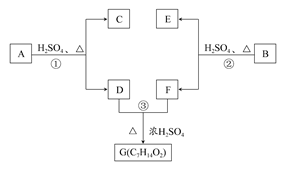
(1)化合物C的分子式是C7H8O,C遇FeCl3溶液显紫色,C的苯环上的一溴代物只有两种,则C的结构简式为;
(2)D为一直链化合物,其相对分子质量比化合物C的小20,它能跟NaHCO3反应放出CO2,则D的分子式为,D具有的官能团名称是;
(3)反应①的化学方程式是;
(4)芳香化合物B是与A具有相同官能团的A的同分异构体,通过反应②化合物B能生成E和F,F可能的结构简式是;
(5)E可能的结构简式是。
《茉莉花》是一首脍炙人口的江苏民歌。茉莉花香气的成分有多种,乙酸苯甲酯
(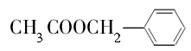 )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下: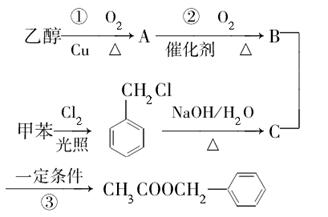
(1)C的结构简式为。
(2)写出反应①的化学方程式:。
(3)反应③的反应类型为。
(4)反应(填序号)原子的理论利用率为100%,符合绿色化学的要求。