在实验中手不慎被玻璃划破,可用FeCl3溶液应急止血,其主要原因可能是
| A.FeCl3溶液有杀菌消毒作用 |
| B.FeCl3溶液能使血液聚集沉降 |
| C.FeCl3溶液能产生Fe(OH)3沉淀堵住伤口 |
| D.FeCl3能使血液发生化学反应 |
某学习小组为了探究 BrO3-+5Br-+6H+=3Br2 +3H2O 反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表:
 实验编号 实验编号相关数据 |
① |
② |
③ |
④ |
⑤ |
| c(H+)/ mol · L-1 |
0.008 |
0.008 |
0.004 |
0.008 |
0.004 |
| c(BrO3-)/ mol· L-1 |
0.001 |
0.001 |
0.001 |
0.002 |
0.002 |
| c(Br-)/ mol· L-1 |
0.10 |
0.20 |
0.20 |
0.10 |
0.40 |
| v / mol· L-1· s-1 |
2.4×10-8 |
4.8×10-8 |
1.2×10-8 |
4.8×10-8 |
v1 |
下列结论不正确的是
A.若温度升高到40℃,则反应速率增大
B.实验②、④,探究的是c(BrO3-)对反应速率的影响
C.若该反应速率方程为v ="k" ca(BrO3-)cb(Br-)cc(H+)(k为常数),则c =2
D.实验⑤中,v1 =4.8×10-8 mol· L-1· s-1
利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
反应一:Ni(粗,s)+4CO(g) Ni(CO)4(g) ΔH < 0
Ni(CO)4(g) ΔH < 0
反应二:Ni(CO)4(g) Ni(纯,s)+4CO(g) ΔH > 0
Ni(纯,s)+4CO(g) ΔH > 0
下列说法错误的是
| A.对于反应一,适当增大压强,有利于Ni(CO)4的生成 |
| B.提纯过程中,CO气体可循环使用 |
| C.升高温度,反应一的反应速率减小,反应二的速率增大 |
| D.对反应二,在180—200℃,温度越高,Ni(CO)4(g)的转化率越高 |
已知反应:2SO2(g)+O2(g)  2SO3(g);ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
2SO3(g);ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是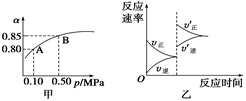

| A.由图甲知,A点SO2的平衡浓度为0.4 mol/L |
| B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2∶1∶2 |
| C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示 |
| D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1 |
固体离子导体依靠离子迁移传导电流,Ag+离子可以在RbAg4I5晶体中迁移。下图是一种固体电池。空气中的O2透过聚四氟乙烯膜与AlI3反应生成I2,Ag和I2作用形成原电池。下列说法中错误的是
| A.I2在石墨上被还原 |
| B.石墨电极为负极,银电极为正极 |
| C.Ag+从负极向正极移动 |
| D.银电极的电极反应是:Ag - e— =Ag+ |
分析能量变化示意图,下列选项正确的是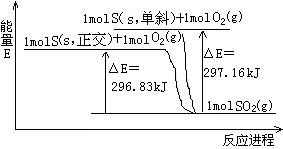
| A.S(s,单斜)+O2(g)=SO2(g)△H ="+297.16" kJ•mol-1 |
| B.S(s,单斜)+O2(g)=SO2(g)△H ="-296.83" kJ•mol-1 |
| C.S(s,正交)+O2(g)=SO2(g)△H ="-296.83" kJ•mol-1 |
| D.单斜硫比正交硫更稳定 |