一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO 3都能被碱石灰和氢氧化钠溶液吸收。用下图装置加热硫酸铜粉末直至完全分解。若硫酸铜粉末质量为10.0 g,完全分解后,各装置的质量变化关系如下表所示。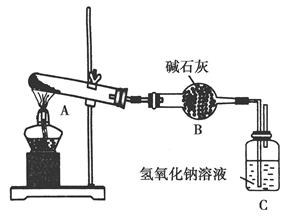
| 装置 |
A(试管+粉末) |
B |
C |
| 反应前 |
42.0 g |
75.0 g |
140.0 g |
| 反应后 |
37.0 g |
79.5 g |
140.0 g |
请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是
A.4CuSO4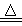 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑
B.3CuSO4 3CuO+SO3↑+2SO2↑+O2↑
3CuO+SO3↑+2SO2↑+O2↑
C.5CuSO4 5CuO+SO3↑+4SO2↑+2O2↑
5CuO+SO3↑+4SO2↑+2O2↑
D.6CuSO4 6CuO+4SO3↑+2SO2↑+O2↑
6CuO+4SO3↑+2SO2↑+O2↑
下列物质中属于有机物的是
| A.C6H6 | B.CH3OH | C.CH3COOH | D.C2H5OH |
下列做法会影响食品安全的是
| A.把三聚氰胺添加到牛奶中 | B.做菜时用适量的地沟油降低成本 |
| C.把发霉的大米淘净后做饭 | D.把色彩鲜艳的着色剂添加到婴幼儿食品中 |
电解质溶液为硫酸铜的铜锌原电池中,铜电极是
| A.负极 | B.发生还原反应的一极 | C.正极 | D.电子流入的一极 |
一定温度下,可逆反应X(g)+3Y(g) 2Z(g)达到平衡的标志是
2Z(g)达到平衡的标志是
| A.正反应速率等于逆反应速率,且不等于零 |
| B.X的浓度不再发生变化 |
| C.Y的浓度不再发生变化 |
| D.Z的浓度不再发生变化 |
下列有关原子结构和元素周期律的表述正确的是
| A.原子序数为15的元素最高化合价为+5 |
| B.同周期元素中,VIIA族元素是非金属性最强的元素 |
| C.氧原子半径比氟原子半径大 |
| D.原子序数为12的元素位于元素周期表的第三周期IIA族 |