有关能量的判断或表示方法正确的是
| A.由H+(aq)+OH-(aq)=H2O(l),△H=-57.3kJ/mol,可知:含1mol CH3COOH的溶液与含1mol NaOH的溶液混合,放出热量等于57.3 kJ |
| B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 |
| C.从C(S、石墨)= C(S、金刚石)△H =" +" 1.9kJ/mol,可知石墨比金刚石更稳定 |
| D.2gH2完全燃烧生成液态水放出285.8kJ热量,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l),△H=-285.8kJ/mol |
下列有关实验原理、方法和结论都正确的是
| A.向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 |
| B.取少量溶液X,向其中加入适量新制氨水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
| C.室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡、静置后分液,可除去苯中少量苯酚 |
D.已知I-3 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
常温下,下列各组离子在制定溶液中一定能大量共存的是
| A.1.0mol▪L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- |
| B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- |
| C.pH=12的溶液:K+、Na+、CH3COO-、Br- |
| D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
下列表示对应化学反应的离子方程式正确的是
| A.FeCl3溶液与Cu的反应:Cu+Fe3+==Cu2++Fe2+ |
| B.NO2与水的反应:3NO2+H2O==NO3-+NO+2H+ |
| C.醋酸溶液水垢中的CaCO3反应:CaCO3+2H+==Ca2++H2O+CO2↓ |
| D.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O==2A(OH)3↓+CO32- |
.以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是
| A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程 |
| B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系 |
| C.电镀时保持电流恒定,升高温度不改变电解反应速率 |
| D.镀锌层破损后对铁制品失去保护作用 |
室温下向10 mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是
| A.溶液中导电粒子的数目减少 |
B.溶液中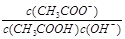 不变 不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10 mL pH=11的NaOH溶液,混合液pH=7 |