在Na+浓度为0.5mol/L的某澄清溶液中,还可能含有下表中的若干种离子:
| 阳离子 |
K+、Ag+、Mg2+、Ba2+ |
| 阴离子 |
NO3-、CO32-、SiO32-、SO42- |
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
| 序号 |
实验内容 |
实验结果 |
| Ⅰ |
向该溶液中加入足量稀HCl |
产生白色沉淀并放出0.56L气体 |
| Ⅱ |
将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 |
固体质量为2.4g |
| Ⅲ |
在Ⅱ的滤液中滴加BaC12溶液 |
无明显现象 |
试回答下列问题:
(1)实验I能确定一定不存在的阳离子是 。
(2)实验I中生成沉淀的离子方程式为 。
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)
| 阴离子 |
NO3- |
CO32- |
SiO32- |
SO42- |
| c/mol·L-1 |
|
|
|
|
(4)判断K+是否存在,若存在求其最小浓度,若不存在说明理由 。
在溶液中,反映
分别在三种不同实验条件下进行,它们的起始浓度均为
、
及
。反映物
的浓度随时间的变化如下图所示。

请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②;
③;
(2)实验②平衡时
的转化率为;实验③平衡时
的浓度为;
(3)该反应的
>0,判断其理由是;
(4)该反应进行到4.0
时的平均反应速度率:
实验②:
=;
实验③:
=。
有
、
、
、
、
和
六瓶无色溶液,他们都是中学化学中常用的无机试剂。纯
为无色油状液体;
、
、
和
是盐溶液,且他们的阴离子均不同。现进行如下实验:
①
有刺激性气味,用沾有浓盐酸的玻璃棒接近
时产生白色烟雾;
②将
分别加入其它五中溶液中,只有
、
中有沉淀产生;继续加入过量
时,
中沉淀无变化,
中沉淀完全溶解;
③将
分别加入
、
、
、
中,
、
、
中产生沉淀,
中有无色、无味气体逸出;
④将
分别加入
、
、
中,均有沉淀生成,再加入稀
,沉淀均不溶。
根据上述实验信息,请回答下列问题:
(1)能确定溶液是(写出溶液标号与相应溶质的化学式):
(2)不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法:
在溶液中,反映 分别在三种不同实验条件下进行,它们的起始浓度均为
分别在三种不同实验条件下进行,它们的起始浓度均为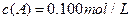 、
、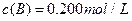 及
及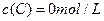 。反映物A的浓度随时间的变化如下图所示。
。反映物A的浓度随时间的变化如下图所示。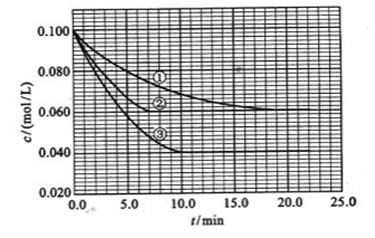

请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②_____________;
③______________;
(2)实验②平衡时B的转化率为_________;实验③平衡时C的浓度为__________;
(3)该反应的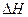 >0,判断其理由是________________;
>0,判断其理由是________________;
(4)该反应进行到4.0min时的平均反应速度率:
实验②: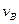 =___________;
=___________;
实验③: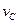 =_______________。
=_______________。
有机化合物A~H的转换关系如下所示:
请回答下列问题:
(1)链烃A有支链且只有一个官能团,其相对分子质量在65~75之间,1 mol A完全燃烧消耗7 mol氧气,则A的结构简式是 ,名称是________________;
(2)在特定催化剂作用下,A与等物质的量的H2反应生成E。由E转化为F的化学方程式是 ;
(3)G与金属钠反应能放出气体,由G转化为H的化学方程式是 ;
(4)①的反应类型是___________;③的反应类型是________________
(5)链烃B是A的同分异构体,分子中的所有碳原子共平面,其催化氢化产物为正戊烷,写出B所有可能的结构简式
(6)C也是A的一种同分异构体,它的一氯代物只有一种(不考虑立体异构,则C的结构简式为 。
有A、B、C、D、E和F六瓶无色溶液,他们都是中学化学中常用的无机试剂。纯E为无色油状液体;B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其它五中溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。
根据上述实验信息,请回答下列问题:
(1)能确定溶液是(写出溶液标号与相应溶质的化学式):
(2)不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法: