有A、B、C、D、E和F六瓶无色溶液,他们都是中学化学中常用的无机试剂。纯E为无色油状液体;B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其它五中溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。
根据上述实验信息,请回答下列问题:
(1) 能确定溶液是(写出溶液标号与相应溶质的化学式):
(2) 不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法:
将0.1 mol的镁和铝的混合物溶于50 mL 4 mol·L-1H2SO4溶液中,然后再滴加2 mol·L-1的NaOH溶液。请回答下列问题:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V的变化如图所示。当V1=80 mL时,计算金属粉末中镁的物质的量及V2的体积。
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,计算滴入NaOH溶液的体积。
含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成含A元素的化合物D。
(1)在元素周期表中,A位于 族,与A同族但相对原子质量比A小的元素B的原子结构示意图为 ,A与B在原子的电子层结构上的相同点是 。
(2)易与C发生化学反应的酸是 ,反应的化学方程式是 。
(3)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F。
①写出生成D和F的化学反应方程式: 。
②要将纯碱高温熔化,下列坩埚中可选用的是 。
A.普通玻璃坩埚B.石英玻璃坩埚
C.氧化铝坩锅D.铁坩锅
(4)100gC与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2 L,100 g混合物中石灰石的质量分数是 。
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂均稍过量)
(1)判断BaCl2已过量的方法是 。
(2)写出第④步相应反应的离子方程式: 。
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是 。
(每空1分,共5分)对于混合物的分离或提纯,常用到的方法有:过滤、蒸发、蒸馏、萃取、加热分解等。下列各组混合物的分离或提纯应采用什么方法?
(1)实验室中的石灰水久置,液面上常悬浮有CaCO3颗粒。可用 的方法除去Ca(OH)2溶液中悬浮的CaCO3颗粒。
(2)碳酸钠易溶于水,不易分解,从其水溶液中得到碳酸钠晶体,可采用 的方法。
(3)提取碘水中的碘,用 方法。
(4)淡化食盐水,可采用 的方法。
(5)除去氧化钙中的碳酸钙可用 的方法。
2012年8月,英国《每日邮报》报道制造太阳镜、婴儿奶瓶、太空杯和光盘的主要材料都是聚碳酸酯,聚碳酸酯在一定条件下可释放出有毒的双酚A(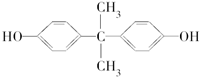 )。聚碳酸酯不耐高温,100℃时释放出的双酚A是25℃时的50倍。双酚A进入人体后,会溶解在身体的血管里,导致致命性的血管疾病。请回答下列问题:
)。聚碳酸酯不耐高温,100℃时释放出的双酚A是25℃时的50倍。双酚A进入人体后,会溶解在身体的血管里,导致致命性的血管疾病。请回答下列问题:
Ⅰ.下列关于双酚A的说法不正确的是________(填序号)。
A.利用聚碳酸酯制成的茶杯来泡茶时对人体无害
B.双酚A的分子式是C15H16O2
C.双酚A的核磁共振氢谱显示有4组峰,且峰面积之比为1∶2∶2∶3
D.1 mol双酚A最多消耗2 mol Br2
Ⅱ.聚碳酸酯(简称PC)是分子链中含有碳酸酯基的高分子聚合物,其合成流程如下: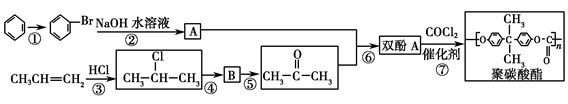
(1)反应①②③④⑤中属于取代反应的有________。
(2)有机物A的结构简式为_________________________________。
(3) 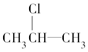 按系统命名法的名称为________。
按系统命名法的名称为________。
(4)CH3CH=CH2与Cl2加成产物的同分异构体有________种(不含加成产物)。
(5)反应⑥的另一产物为________。
(6)写出反应⑤⑦的化学方程式:
反应⑤_________________________________________________________。
反应⑦________________________________________________________,
该反应的反应类型为____________________________________________。