水煤气不仅是合成氨的原料气也是合成烃及其化工产品的原料。
(1)直接水煤气燃料电池中,通CO、H2的极为电池的 极(选填:“正”,“负”)。
(2)水煤气变换反应:CO(g) + H2O(g)  CO2(g) + H2(g) △H < 0,下列措施能提高反应速率的有 (不定项选择)。
CO2(g) + H2(g) △H < 0,下列措施能提高反应速率的有 (不定项选择)。
a.升高温度 b.加入催化剂 c.增大压强 d.降低浓度
(3)由水煤气可以合成甲醇(CH3OH)。已知0.5 mol CH3OH(l)完全燃烧生成二氧化碳气体和液态水时放出热量为363.2 kJ,写出CH3OH(l)燃烧的热化学方程式 。
(1)下列各组物质:①金刚石和C60 ②H、D和T ③乙烷和已烷④CH3(CH2)2CH3和(CH3)2CHCH3中,互为同位素的是(填序号,下同)__ ___,互为同素异形体的是_ __,互为同系物的是_____,属于同分异构体的是__ ___。
(2)请写出2,3-二甲基丁烷的结构简式:
(3)请用系统命名法命名该烷烃CH3CH(C2H5)CH(CH3)2:
某同学需要0.40 mol/L的CuSO4溶液240mL,用胆矾晶体(CuSO4·5H2O)来配制。请回答下列问题:
(1)现有配制过程中所需仪器:托盘天平、药匙、烧杯、量筒、胶头滴管,还需用到的玻璃仪器的名称是 。
(2)请写出该实验的简要的实验步骤:①计算 ②称量胆矾 g ③ ④转移⑤洗涤并转移⑥定容⑦摇匀
(3)简述操作⑥的具体过程: ____。
(4)该同学在定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。对所配溶液浓度的影响是 (填“偏高”、“偏低”或“无影响”)。
粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥砂等不溶性杂质,我们食用的精盐是用粗食盐提纯而得到的,通过教材中“粗盐的提纯”及你做过的该实验回答下列问题。
(1)除去SO42-时应加入的试剂名称为 ,
检验SO42-已经沉淀完全的操作是: 。
(2)在加入稍过量的碳酸钠溶液后将溶液过滤,滤液中含NaOH和Na2CO3两种杂质,写出除去这两种杂质时发生反应的化学方程式 、 。
(1)某气态氧化物的化学式为XO2,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为 。
(2)同温同压下,同质量的SO2与He的体积之比为 。
(3)设NA为阿伏加德罗常数的值,若a g某气体中含有该气体的分子数为b,则c g该气体在标准状况下的体积为 L.(用NA、a、b、c的代数式表示)
钴及其化合物可作为一些化学合成的催化剂,亦用于油漆、颜料、玻璃、釉瓷及电极板等的制造。
(1)粉红色、不溶于水的Co(OH)2具有两性,其溶于盐酸的离子方程式为_ ,Co(OH)2在空气中慢慢被氧化为棕褐色的Co(OH)3,反应的化学方程式为______________________。
(2)CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)可用作H2O2分解的催化剂,具有较高的活性。
①该催化剂中铁元素的化合价为_ 。
②两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化的曲线如图所示。由图中信息可知:_ 法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果较好的是_ 。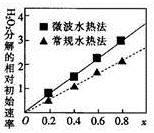
(3) CoCl2常用作多彩水泥的添加剂,可用钴的氧化物(其中Co的化合价为+2、+3)制备,用480 mL 5 mol·L-1盐酸恰好将其完全溶解,得到CoCl2溶液和6.72 L(标准状况下)黄绿色气体。则该钴的氧化物的化学式为_ 。