有如下两个反应
A:2HCl+Ba(OH)2=BaCl2+2H2O B:2Fe3++Cu=2Fe2++Cu2+
(1)根据两反应的本质,判断能否设计成原电池:A ,B ,(填“能”或“不能”)不能设计成原电池的原因是 ;
(2)根据能设计成原电池的反应选择适合的材料和试剂设计一个原电池
①负极材料是 ,正极材料是 ,电解质溶液是 ;
②写出负极的电极反应式 ;
③若导线上转移电子0.2 mol,则负极质量减少 。
已知A、B为常见的金属单质,C、D为常见的非金属单质,甲、乙、丙为三种常见的化合物,甲是中学化学中常见的红棕色粉末状固体,它们之间的相互转化关系如图所示(部分产物及反应条件没有列出):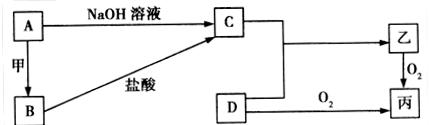
(1)写出框图中A转化为B的化学方程式:_______________________________________,该反应属于______________(填“吸热反应”或“放热反应”)。
(2)若乙的水溶液呈弱酸性,丙是一种大气污染物、有刺激性气味。已知16 g固体单质D完全燃烧转化成丙时,放出148.4 kJ的热量,则该反应的热化学方程式为:
_____________________________________________________________________________。
(3)若乙在水溶液中呈弱碱性,其盐可用作化肥,且C与D化合生成乙的反应是可逆反应。
①将等物质的量的C、D两种单质充入一体积恒定的密闭容器中,在适当催化剂和恒温条件下反应,下列说法中不正确的是____________(填字母)。
a.达到化学平衡时,2υ正(C) = 3υ逆(乙)
b.反应过程中,D单质的体积分数始终为50%
c.达到化学平衡时,混合气体的密度保持不变
d.达到化学平衡的过程中,气体的平均相对分子质量逐渐增大
e.达到化学平衡后,再升高温度,乙的体积分数增大
②若在一个体积为10 L的密闭容器中,充入8 mol C单质和2 mol D单质,在一定温度下发生反应生成气体乙,经40 min后反应达到平衡,此时C的转化率为37.5%。从反应开始到达平衡的40 min内,用物质乙表示的化学反应速率为_________________________;达到平衡后,若向容器中按5∶1∶2的物质的量之比再次充入C、D、乙三种物质,则原平衡体系中C的转化率将_____________(填“增大”、“减小”或“不变”)。
某有机物蒸汽对H2的相对密度为43,请根据以下信息回答相应的问题:
(1)若该有机物A属于烃类,则分子式为_______________;写出其同分异构体中,一溴代物有3种物质的结构简式并命名:
____________________________________________________________________________。
(2)若该有机物B分子中C、H、O的原子个数之比为2∶3∶1,B物在酸性条件下水解可生成碳原子数相同的两种有机物C和D,B通过加聚反应可制得有机高分子化合物M,M常用做木材的黏合剂,俗称“乳白胶”。
①B分子中不含氧的官能团的名称为_________________________;
②B的同分异构体中属于链状不饱和羧酸的有三种,它们的结构简式是:
_________________________、_______________________、_________________________;
③写出B在一定条件下加聚反应生成M的化学方程式:
_____________________________________________________________________________;
④通常羟基与双键碳原子直接相连时,易发生下列转化: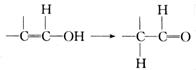
D能发生银镜反应,请写出D的结构简式:______________________________;
⑤已知:
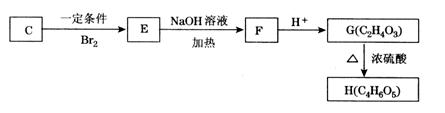
C可以发生如上图所示转化关系,写出以下化学方程式:
E→F:__________________________________________________________________;
G→H:__________________________________________________________________。
短周期主族元素A、B、C、D原子序数依次增大,且只有C为金属元素。A、C位于同一主族,B是地壳中含量最多的元素,B、C的最外层电子数之和与D的最外层电子数相等。请回答下列问题:
(1)D的最高价氧化物的水化物的名称为__________________。
(2)C2B2的电子式为_________________________,其中含有的化学键类型为
_________________。
(3)由上述四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分。将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式为:
________________________________________________________________________。
(4)用石墨电极电解CD的饱和溶液,电解反应的离子方程式为:________________________________________,若反应后溶液的体积为200 mL,测得pH为13(常温下测定),则阳极得到的气体质量为_______________,外电路中通过电子的物质的量为___________________。
(5)实验室欲检验CD溶液中所含的D–,操作方法和现象为_____________________________________。
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图: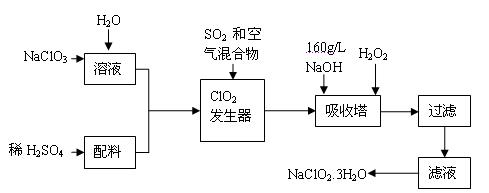
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2 3H2O。
3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③HClO2可看成是强酸。
(1)160 g/L NaOH溶液的物质的量浓度为 。若要计算该溶液的质量分数,还需要的一个量是 (用文字说明)。
(2)发生器中鼓入二氧化硫的作用可能是 (填序号)。
A.将SO2氧化成SO3,增强酸性 B.稀释ClO2以防止爆炸;
C.将NaClO3还原成ClO2
(3)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是。
(4)吸收塔内的反应的化学方程式为 。吸收塔的温度不能超过20℃,其目的是防止H2O2分解,写出H2O2分解的化学方程式:。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (填序号)。
A.Na2S B.Na2O2C.FeCl2
(6)从滤液中得到NaClO2 3H2O粗晶体的实验操作依次是 (填序号)。
3H2O粗晶体的实验操作依次是 (填序号)。
A.蒸发 B.蒸馏 C.冷却结晶 D.灼烧 E.过滤
要得到更纯的NaClO2 3H2O晶体能否加热蒸干 (填“能”或“不能”)。
3H2O晶体能否加热蒸干 (填“能”或“不能”)。
钠是很活泼的金属,在空气中燃烧的产物是Na2O2。Na2O的制取一般可以通过下列两个反应完成:
反应①: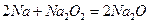
反应②: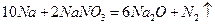
(1)分析以上两个反应,完成下表:
| 作氧化剂的元素(填元素符号) |
基本反应类型 |
|
| 反应① |
||
| 反应② |
置换反应 |
(2)按照绿色化学的原则,最理想的“原子经济”就是反应物的原子全部转化为所期望的最终产物,上述两个反应中满足“原子经济”要求的是(填序号)
(3)欲将23g钠全部转化成Na2O,现按照反应:①进行反应,需先将一部分钠氧化成Na2O2,则被氧化成Na2O2的金属钠的物质的量为。
(4)Na2O在空气中很容易进一步氧化成Na2O2。100g某Na2O样品(含Na2O2)中加入足量的水,生成5.6L气体(标准状况),则样品中Na2O的质量分数为。