A、B、X、Y均为中学阶段的常见物质,它们之间的转化关系如下图所示: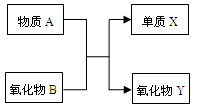
请回答下列问题:
(1)若A为金属单质,B为非金属氧化物,则该反应的化学方程式为 ;请写出质量数为26的A的一种核素符号 。
(2)若A为非金属单质,B为非金属氧化物,且A、X为同主族元素,则该反应的化学方程式为 。
下表列出前20号元素中的某些元素性质的一些数据:
| 元素 性质 |
A |
B |
C |
D |
E |
F |
G |
H |
I |
J |
| 原子半径(10-10m) |
1.02 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
1.17 |
| 最高价态 |
+6 |
+1 |
— |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
+4 |
| 最低价态 |
-2 |
— |
-2 |
— |
-4 |
-3 |
-1 |
— |
-3 |
-4 |
试回答下列问题:
(1)已知H为Na元素,则以上10种元素中第一电离能最小的是:(写元素符号)。比元素B原子序数大10的元素其基态原子的核外电子排布式是。
(2)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其一分子中共形
成个σ键,个π键。
(3) 短周期某主族元素K的电离能情况如图(A)所示。则K元素位于周期表的第族。
图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第族元素氢化物的沸点的变化规律。
不同同学对某主族元素的氢化物的沸点的变化趋势画出了两条折线—折线a和折线b,你认为正确的是,理由是
(14分,每空2分) 硫酸亚铁容易被氧化,而硫酸亚铁 铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。现以铁屑为主要原料制备硫酸亚铁铵晶体,其反应如下:Fe+H2SO4(稀)
铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。现以铁屑为主要原料制备硫酸亚铁铵晶体,其反应如下:Fe+H2SO4(稀)FeSO4+H2↑
FeSO4+(NH4)2SO4+6H2O(NH4)2SO4·FeSO4·6H2 O
O
步骤l:在盛有适量铁屑的锥形瓶里加入某种试剂除去油污,加热,充分反应后过滤、
洗涤、干燥、称量,铁屑质量为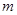 。
。
步骤2:将处理过的铁屑加入到一定量的稀H2SO4中,加热至50℃—80℃充分反应,
趁热过滤并用少量热水洗涤,滤液及洗涤液都转移至蒸发皿中。滤渣干燥后称重,剩余铁屑质量为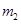 。
。
步骤3:准确称取所需质量的硫酸铵晶体加入“步骤2”的蒸发皿中,搅拌 使之溶解,
使之溶解,
缓缓加热一段时间,将其冷却结晶、过滤。用无水乙醇洗涤晶体并自然干燥,称量所 得晶体质量为
得晶体质量为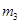 。
。
回答下列问题:
(1)能够用于除去铁屑表面油污的试剂是(填字母)。
| A.纯碱溶液 | B.烧碱溶液 | C.明矾溶液 | D.稀硫酸 |
(2)步骤2中趁热过滤的目的是。
(3)硫酸亚铁在潮湿的空气中易被氧化生成一种物质 (碱式硫酸铁),该反应的化学方程式为。
(碱式硫酸铁),该反应的化学方程式为。
(4)铁屑表面常有少量的铁锈(Fe2O3·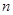 H2O),对FeSO4的制备(填“有”、“无”)影响,理由是(用离子方程式回答)。
H2O),对FeSO4的制备(填“有”、“无”)影响,理由是(用离子方程式回答)。
(5)若忽略铁锈的影响,上述实验中硫酸亚铁铵 晶体的产率为
晶体的产率为 。
。
(6)请设计一个简单的实验,检验硫酸亚铁铵晶体中含有结晶水(简述实验操作、现象和结论) 。
(12分,每空2分) 现有A、B、C、D、E、F六种常见化合物,已知它们:阳离子分别有K+、Ag+、Na+、Ba2+、Fe2+、Al3+;阴离子分别有Cl-、OH-、AlO、 NO、SO、CO。将它们分别配成0.1 mol/L的溶液进行如下实验:
NO、SO、CO。将它们分别配成0.1 mol/L的溶液进行如下实验:
①测得溶液A、C、E均呈碱性,且碱性:A>E>C,E的焰色呈浅紫色(透过蓝色钴玻璃观察);
②向B溶液中滴加稀氨水至过量,先生成沉淀,后沉淀全部溶解;
③向F溶液中滴加稀硝酸,溶液变成棕黄色,且有无色气体生成;
④向D溶液中滴 加Ba(NO3)2溶液无明
加Ba(NO3)2溶液无明 显现象。
显现象。
(1)写出A、D、E、F的化学式:
A__________________;
D__________________;
E__________________;
F__________________。
(2)用离子方程式解释C溶液的碱性:________________________________________。
(3)写出实验③中反应的离子方程式:_________________________________________。
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
(1)写出该反应的化学方程式 ,其中氧化剂是, 8.4g铁粉参加反应,转移电子mol。
,其中氧化剂是, 8.4g铁粉参加反应,转移电子mol。
(2)干燥管内使用的干燥剂可以是下列物质中的(填序号)。
①浓硫酸②碳酸钠③碱石灰④过氧化钠
(3)硬质玻璃管中石棉绒的作用是,圆底烧瓶中盛装水和,加入后者的作用是。
(4)实验开始时应先点燃,实验结束时应先熄灭,检验生成的气体 的方法是。
的方法是。
下图是中学化学中常见物质的转化关系,部分物质和反应条件略去。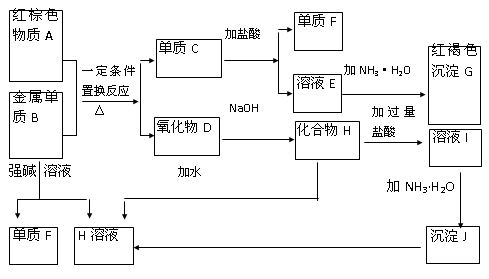
(1)单质B的化学式是,单质F的化学式是________ ,写出物质A的一种用途。
(2)写出单质B与强碱溶液反 应的离子方程式,
应的离子方程式,
写出由沉淀J生成 H溶液的离子方程式,
(3)溶液E中加入氨水时,先生成白色沉淀L,写出生成L的离子方程式,
白色沉淀L会迅速变为色,最终变为红褐色沉淀G,写出L变为G的化学反应方程式。
(4)溶液I中所含金属离子是_____________________。