已知有A、B、C、D、E五种短周期元素,核电荷数依次增加。
| 元素 |
有关性质及结构信息 |
| A |
形成的单质密度最小 |
| B |
基态原子核外L层的P电子数等于S电子数 |
| C |
原子核外有8种运动状态不同的电子 |
| D |
海水中含量最高的金属元素 |
| E |
E的氧化物是形成酸雨的主要物质之一 |
(1)甲是由A、B、C三种元素组成的相对分子质量最小的物质。由甲中的两种元素组成,且与甲等电子的物质的电子式是 ,该物质与C的单质在KOH溶液中形成燃料电池的负极反应式为 。
(2)均由A、C、D、E四种元素组成的两种物质丙和丁在溶液中可发生反应,该化学方程式为 。
(3)由A、B两种元素组成的气体分子有多种,其中乙是一个含4个原子的分子,乙的结构式为 。已知乙的燃烧热为1200 kJ∕mol,乙燃烧热的热化学反应方程式为 。
(4)A与C可形成一种物质戊,在酸性条件下,将少量戊加入淀粉KI溶液后,溶液显蓝色,反应的离子方程式为 。用酸性高锰酸钾溶液滴定法可测定戊溶液中戊的含量,若滴定中消耗0.50mol/L的高锰酸钾溶液40.00mL,则此溶液中戊的质量为____________ g。
(5)E2-基态核外电子排布式为 ,在A、B、C形成的多种分子中,有些分子的核磁共振氢谱显示有三种氢,且峰面积比为1﹕2﹕3,写出其中一种分子的名称: 。
能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。阅读下列有关能源的材料,回答有关问题:
(1)沼气是一种廉价能源,农村存在大量的秸秆、杂草等废弃物,它们经微生物发酵之后,便可产生沼气,可用来点火做饭。在农村推广建造沼气池,不仅能有效地利用__▲__能,还能为农业生产提供优良的肥料。已知8 g甲烷完全燃烧生成液态水时放出445.0kJ的热量,请写出甲烷燃烧的热化学方程式________▲_______________。
(2)从能量的角度看,断开化学键要 ▲__,形成化学键要 ▲__。已知拆开1 mol H-H键、1 molN≡N、1 mol N-H键分别需要吸收的能量为436 .4kJ、941.3 kJ、390.5 kJ。则由氢气和氮气反应生成1 mol NH3需要 ▲__(填“放出”或“吸收”)▲__kJ的热量。
(3)在生产和生活中经常遇到化学能与电能的相互转化。在下列甲、乙两装置中,甲中负极电极反应式为▲_______,溶液中的阳离子向_▲___极移动;乙中铁电极的电极反应式为__▲___,发生_▲___反应(填“氧化”或“还原”)。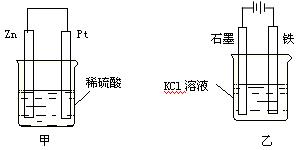
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
⑴煤的气化的主要化学反应方程式为:___________________________。
⑵煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:________________________________________。
⑶利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)  CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g)  CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)  CH3OCH3(g) + CO2 (g) ΔH=-246.4kJ· mol -1;
CH3OCH3(g) + CO2 (g) ΔH=-246.4kJ· mol -1;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是_______(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
⑷已知反应②2CH3OH(g)  CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
①比较此时正、逆反应速率的大小:v正 ______ v逆(填“>”、“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________。
有机化合物A~H的转换关系如下所示: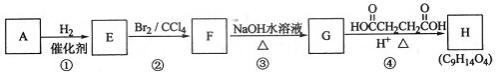
请回答下列问题:
(1)链烃A有支链且只有一个官能团,其相对分子质量在65~75之间,1 mol A完全燃烧消耗7 mol氧气,则A的结构简式是,名称是
(2)在特定催化剂作用下,A与等物质的量的H2反应生成E。由E转化为F的化学方程式是
(3)G与金属钠反应能放出气体,由G转化为H的化学方程式是
(4)①的反应类型是;③的反应类型是
(5)链烃B是A的同分异构体,分子中的所有碳原子共平面,其催化氢化产物为正戊为烷,写出B所有可能的结构简式
(6)C也是A的一种同分异构体,它的一氯代物只有一种(不考虑立体异构),则C的结构简式为。
有机物A的结构简式为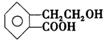 ,它可通过不同化学反应分别制得B、C、D和E四种物质
,它可通过不同化学反应分别制得B、C、D和E四种物质
请回答下列问题:
(1)指出反应的类型:A→C:
(2)在A→E五种物质中,互为同分异构体的是(填代号)。
(3)写出由A生成B的化学方程式。
(4)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有的原子有可能都在同一平面的物质是(填序号)。
(5)C能形成高聚物,该高聚物的结构简式为。
(6)写出D与NaOH溶液共热反应的化学方程式。
(10分)现有五种短周期元素A、B、C、D、E,其原子序数依次增大。A、E同主族,A元素原子半径最小。B元素原子的最外层电子数是内层电子数的2倍。C元素最高价氧化物对应水化物X与其氢化物Y反应生成一种盐。A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。试回答下列问题
(1)写出D、E两元素形成的原子个数比为1︰2的化合物的电子式______________
(2)写出Y与氯化铁溶液反应的离子方程式___________________
(3)某盐由A、B、D、E四种元素组成,其化学式量为82。该盐化学式_______,写出该盐与稀硫酸反应的离子方程式_____________________
(4)汽车尾气中含有B、C的氧化物,它们均为有害气体。在钯(Pd)等过渡金属的催化下,这两种气体可以相互反应转化为无害气体。请写出该转化反应的化学方程式
_____________________________________________________________________