阿司匹林(乙酰水杨酸)已应用百年,成为医药史上三大经典药物之一,至今它仍是世界上应用最广泛的解热、镇痛和抗炎药,也是作为比较和评价其他药物的标准制剂。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成该物质,设计的合成路线为:
一、制备K
二、提纯
方案1
方案2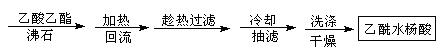
主要试剂和产品的物理常数
| 名 称 |
相对分子质量 |
熔点或沸点(0C) |
水 |
醇 |
醚 |
| 水杨酸 |
138 |
158(熔点) |
微溶 |
易溶 |
易溶 |
| 醋酸酐 |
102 |
139.4(沸点) |
反应 |
可溶 |
易溶 |
| 乙酰水杨酸 |
180 |
135(熔点) |
微溶 |
可溶 |
微溶 |
请根据以上信息回答下列问题:
(1)①合成阿斯匹林时,还会生成一些副产品,其中有一种是高分子,为了分离此物质,方案1中加入A物质为 ▲ 溶液。
②本方案抽滤后进行洗涤,其具体操作是 ▲ 。
(2)方案2为改进的提纯方法,称为重结晶提纯法。
①该方案中步骤1除了选用乙酸乙酯外,还可选择下列哪些
试剂 ▲ 。
A. 乙醇 B. 蒸馏水 C. 乙醚
②步骤2回流的装置如图所示,写出仪器a的名称 ▲ ,使用温度计的目的是 ▲ ,冷凝水的流向为 ▲ 。
③方案2所得产品的有机杂质要比方案1少的原因是 ▲ 。
(3)该学习小组在实验中原料用量:2.0g水杨酸、5.0ml醋酸酐(ρ=1.08g·cm-3),
最终称量产品m="2.2g" ,则乙酰水杨酸的产率为 ▲ 。
某厂废水中含5.00×10-3 mol·L-1的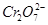 ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程:
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程: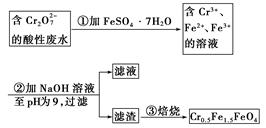
(1)第①步反应的离子方程式是__________________________________________________
________________________________________________________________________。
(2)第②步中用pH试纸测定溶液pH的操作是:_______________________________________
________________________________________________________________________。
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有________________。
(4)欲使1 L该废水中的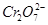 完全转化为Cr0.5Fe1.5FeO4,理论上需要加入____________g FeSO4·7H2O。
完全转化为Cr0.5Fe1.5FeO4,理论上需要加入____________g FeSO4·7H2O。
用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166 g·mol-1)等新型净水剂替代传统的净水剂Cl2,对淡水进行消毒是城市饮用水处理的新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是____________>___________>________ _。
(2)高铁酸钠之所以能净水,除它本身具有强氧化性外,另一个原因可能是_________________________________________________________________________。
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。请回答下列问题:
(1)天然水中溶解的气体主要有________、________;
(2)天然水在净化处理过程中加入的混凝剂可以是________________________________(填其中任何两种)其净水作用的原理是___________________________________________ _____________________________;
(3)水的净化与软化的区别是____________________________________________________
________________________________________________________________________;
(4)硬度为1°的水是指每升水含10 mg CaO或与之相当的物质(如7.1 mg MgO)。若某天然水中c(Ca2+)=1.2×10-3 mol·L-1,c(Mg2+)=6×10-4 mol·L-1,则此水的硬度为________;
(5)若(4)中的天然水还含有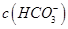 =8×10-4 mol·L-1,现要软化10 m3这种天然水,则需先加入Ca(OH)2________ g,后加入Na2CO3________ g。
=8×10-4 mol·L-1,现要软化10 m3这种天然水,则需先加入Ca(OH)2________ g,后加入Na2CO3________ g。
23实验室有一瓶碳酸钠试剂,含有少量的硫酸钠杂质,某学生设计以下实验来确定其纯度。
| A.称取样品W1 g | B.加盐酸酸化 | C.用蒸馏水溶解 | D.过滤 |
E.加入过量的氯化钡溶液 F.洗涤沉淀 G.干燥沉淀 H.称量沉淀的质量W2 g
(2)酸化时盐酸必须过量,其目的是______。
(3)氯化钡溶液要过量的目的是______。检验氯化钡过量的方法是______。
(4)检验沉淀已洗涤干净的方法是______。
(5)样品中碳酸钠的纯度为______。
请利用下列装置及试剂组装一套装置。其流程是,用浓盐酸和MnO2先制取纯净干燥的Cl2(不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性。试回答: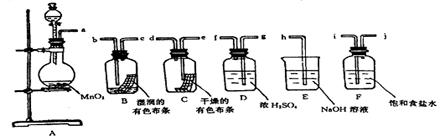
(1)按气体从左向右流向将各装置依次连接起来(填接口标号):
a接,接,接,接,接 h。
装置中存在什么问题。
(2)烧瓶中发生反应的化学反应方程式是。
(3)D装置的作用是,F装置的作用是。
(4)C瓶中的现象是,以上事实说明起漂白作用的物质是。
(5)E中反应的离子方程式是。