Ⅰ.已知下列反应的热化学方程式为:
C(s) + O2(g) CO2(g) ΔH1 =" -393.5" kJ/mol
CO2(g) ΔH1 =" -393.5" kJ/mol
CH3COOH(l) + 2O2(g) 2CO2(g) + 2H2O(l) ΔH 2 =" -870.3" kJ/mol
2CO2(g) + 2H2O(l) ΔH 2 =" -870.3" kJ/mol
2H2(g) + O2(g) 2H2O(l) ΔH 3 =" -571.6" kJ/mol
2H2O(l) ΔH 3 =" -571.6" kJ/mol
请计算2C(s) + 2H2(g) + O2(g) CH3COOH(l) ΔH 4 = 。
CH3COOH(l) ΔH 4 = 。
Ⅱ.在某温度下,物质(t-BuNO)2在正庚烷或CCl4溶剂中均可以发生反应:
(t-BuNO)2 2(t-BuNO)
2(t-BuNO)
该温度下该反应在CCl4溶剂中的平衡常数为1.4mol/L。
(1)向1 L正庚烷中加入0.50 mol (t-BuNO)2,10 min时反应达平衡,此时(t-BuNO)2的平衡转化率为60%(假设反应过程中溶液体积始终为1 L)。反应在前10 min内的平均速率为v(t-BuNO)= 。计算上述反应的平衡常数K。(写出计算过程,计算结果保留3位有效数字)
(2)有关反应:(t-BuNO)2  2(t-BuNO) 的叙述正确的是________
2(t-BuNO) 的叙述正确的是________
A.压强越大,反应物的转化率越大 B.温度升高,该平衡一定向右移动
C.溶剂不同,平衡常数K值不同
(3)通过比色分析得到40℃时(t-BuNO)2和(t-BuNO)浓度随时间的变化关系的几组数据如下表所示,请在同一图中绘出(t-BuNO)2和(t-BuNO)浓度随时间的变化曲线。
| 时间(min) |
0 |
1 |
3 |
5 |
7 |
9 |
11 |
| c(t-BuNO)2 mol/L |
0.05 |
0.03 |
0.01 |
0.005 |
0.003 |
0.002 |
0.002 |
| c(t-BuNO) mol/L |
0 |
0.04 |
0.08 |
0.09 |
0.094 |
0.096 |
0.096 |

Ⅲ.甲醇燃料电池的电解质溶液是KOH溶液。则通入甲醇的电极反应式为 。若通空气的电极上有32g O2参加反应,则反应过程中转移了______ mol e-。
信息提示:卤代烃的代表物溴乙烷的主要化学性质如下:
(1)溴乙烷的取代反应
CH3CH2Br+H2O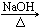 CH3CH2OH+HBr
CH3CH2OH+HBr
(2)溴乙烷的消去反应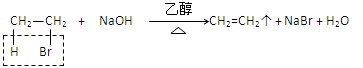
某芳香烃A有如下转化:
请回答下列问题:
(1)写出反应类型:②⑤;写出E所含的官能团:
(2)写出结构简式A,E。
(3)写出化学反应方程式:
反应③,
反应⑤。
人体内缺乏维生素A会使人患夜盲症,原因是维生素A在人体内易被氧化为视黄醛,而视黄醛的缺乏是引起视觉障碍的主要原因。已知视黄醛结构为:
(1)检验醛基的试剂是,实验现象:。
(2)检验碳碳双键的试剂是,实验现象:。
(3)实验中先检验哪种官能团?
现有下列物质, 用编号填空回答下列问题:(每空各2分多选错选不得分)
| A.干冰 | B.金刚石 | C.氩 | D.过氧化钠 E.二氧化硅 F. 溴化铵 |
(1)通过非极性键形成的原子晶体是:。
(2)可由原子直接构成的分子晶体是: 。
(3)含有离子键、共价键、配位键的化合物是:。
(4)含有非极性键的离子化合物是:。
下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用相应化学用语回答下列问题:
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
(1)画出表中形成化合物种类最多元素的原子结构示意图 __ ;
写出它与原子半径最小的原子形成六核且为平面结构的化合物的电子式_____。
(2)④⑤⑧形成的简单离子半径由大到小的顺序为_______________(填离子符号);③⑦⑨的最高价氧化物对应水化物的酸性由强到弱的顺序为_____________________。(填化学式)
(3)工业上用②单质大量生产⑦单质,反应的化学方程式为:________________________________
⑦形成氧化物的晶体类型为__________,它的一种重要用途为。
(4)这些元素形成的氧化物中,不溶于水,但既能与强酸又能与强碱反应的是___________(填化学式),写出它与⑤的最高价氧化物对应水化物发生反应的离子方程式_________________________________。
(5)X、Y由①②④中的两种或三种元素组成。X的溶液能与小苏打反应产生Y,若X是其所属系列中最简单的分子,且相对分子质量为46,则X的名称为,写出X溶液与小苏打反应的化学方程式为____________。
烯丙醇是一种无色有刺激性气味的液体,是重要的有机合成原料,其结构简式为 CH2=CH—CH2OH。请回答:
(1)烯丙醇的分子式为;烯丙醇中含有的官能团的名称是____。
(2)0.3mol 烯丙醇与足量金属钠反应,能生成标准状况下的氢气L。
(3)写出烯丙醇与溴水反应的化学方程式,反应类型为:_____________________。
(4)烯丙醇与CH3CO18OH发生酯化反应的化方程式为,酯化反应生成的产物在一定条件下可以发生加聚反应得到高分子化合物,其结构简式为 。