有一瓶无色澄清溶液,其中可能含有Na+、Mg2+、Ba2+、Cl-、SO 42-、CO32-离子。现进行以下实验:
42-、CO32-离子。现进行以下实验:
①用pH试纸检验溶液,发现溶液呈强酸性;
②取部分溶液逐滴加入NaOH溶液,使溶液由酸性变成碱性,无沉淀产生;
③取少量②中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生。
(1)根据上述事实确定:该溶液中肯定存在的离子有 ;肯定不存在的离子有 ;可能存在的离子有
;肯定不存在的离子有 ;可能存在的离子有  。
。
(2)写出③中发生反应的离子方程式 。
有一种pH为12的NaOH溶液100 mL,要使它的pH降到11,
(1)如果加入蒸馏水,应加 mL;(提示:溶液总体积具有加和性。下同)
(2)如果加入pH=l0的NaOH溶液,应加_______ mL;
(3)如果加入0.01 mol·L-1的盐酸,应加_______ mL。
下列一句话中叙述了两个值,前者记为M,后者记为N,M和N的关系从A、B、C、D中选择,并填空
A. M>NB. M<NC. M=ND. 无法比较
(1)相同温度下,1L 1 mol/L 的NH4Cl溶液中的NH4+个数和2 L 0.5 mol/L NH4Cl溶液中NH4+的个数: ;
(2)常温下两份等浓度的纯碱溶液,将第二份升高温度,两溶液中c(HCO3-): ;
(3)室温下某强酸和某强碱溶液等体积混合后,溶液的pH值为7,原酸溶液和原碱溶液的物质的量浓度: ;
(4)用惰性电极分别电解NaCl溶液和CuSO4溶液,一段时间后,则两个电解池中前者阴极附近溶液的PH与后者阳极附近溶液的PH大小关系是: ;
(5)同条件下,一堆钢管单独露天堆放,另一堆钢管与铜管露天堆放在一起,则两堆钢管腐蚀的速率: ;
(6)PH值相同的醋酸和盐酸,分别用蒸馏水稀释至原来的M倍和N倍,稀释后两溶液的PH值仍然相同,则M和N的关系是: 。
某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO。实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生。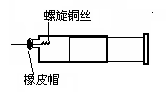
(1)请写出铜与稀硝酸反应的化学方程式__________________。
(2)若证明无色气体是NO的实验操作和现象是________________。
一氧化氮是大气污染物之一。目前,有一种治理方法是在400 ℃左右、有催化剂存在的情况下,用氨把一氧化氮还原为氮气和水。该反应的化学方程式为4NH3+6NO 5N2+6H2O,每有10mol N2生成,氧化产物与还原产物的比___________,反应中转移的电子的电子数为___________。
5N2+6H2O,每有10mol N2生成,氧化产物与还原产物的比___________,反应中转移的电子的电子数为___________。
(3)若将上述稀硝酸换成浓硝酸,其生成的气体通入水中,发生反应的化学方程式为____________。
(4)分别将等质量的铜片与等体积过量的浓、稀硝酸反应,所得溶液前者呈绿色,后者呈蓝色。某同学认为可能是Cu2+浓度的差异引起的,你认为是否正确? (填“正确”或“不正确”),理由是 。
(5)①写出实验室由NH4Cl和Ca(OH)2加热制取氨气的化学方程式:__________________;检验氨气已收集满的方法是: 。
②进行喷泉实验,若在水中加入酚酞,得到红色喷泉。该实验体现了氨气的两个重要性质分别是_______________、______________。
已知: I2+2S2O32-=S4O62-+2I-。相关物质的溶度积常数见下表:
| 物质 |
Cu(OH)2 |
Fe(OH)3 |
CuCl |
CuI |
| Ksp |
2.2×10-20 |
2.6×10-39 |
1.7×10-7 |
1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O,加入CuO,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)= 。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O。
(2)在空气中直接加热CuCl2·2H2O得不到纯的无水CuCl2,原因是 (用化学方程式表示)。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀(发生反应:2Cu2++4I- 2CuI↓+I2)。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
2CuI↓+I2)。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
① 可选用 作滴定指示剂,滴定终点的现象是 。
② 该试样中CuCl2·2H2O的质量分数为 。
已知t ℃时,0.01 mol·L-1NaOH溶液的pH="11,0.1" mol·L-1的HA溶液中c(H+)/c(OH-)=109。请回答下列问题:
(1) 该温度下,水的离子积KW= ,HA是 (填“强”或“弱”) 酸。
(2) 该温度下,将pH之和为13的NaOH溶液和HA溶液等体积混合后,所得溶液呈 (填“酸”、“碱”或“中”) 性。
(3) 在室温下,用蒸馏水稀释0.01 mol·L-1 HA溶液时,下列各项呈减小趋势的是 。
A.c(H+)/c(A-)
B.c(HA)/c(A-)
C.溶液中c(H+)和c(OH-)的乘积
D.溶液中c(A-)·c(HA)的值
E.水的电离程度
(4) 室温下,取pH=2的盐酸和HA溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示:
①图中表示HA溶液pH变化曲线的是 (填“A”或“B”)。
②设盐酸中加入Zn的质量为m1,HA溶液中加入Zn的质量为m2,则m1 m2(填“>”、“<”或“=”)。