液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示,
该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是
| A.b极发生氧化反应 |
| B.a极的反应式:N2H4+4OH–-4e-== N2↑+4H2O |
| C.放电时,电流从a极经过负载流向b极 |
| D.其中的离子交换膜需选用阳离子交换膜 |
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。下列“水” 电池在海水中放电时的有关说法正确的是( )
| A.正极反应式:Ag+Cl--e-="AgCl" |
| B.每生成1 mol Na2Mn5O10转移2 mol电子 |
| C.Na+不断向“水”电池的负极移动 |
| D.AgCl是还原产物 |
现有0.4 mol·L-1HA溶液和0.2 mol·L-1NaOH溶液等体积混合组成溶液。下列有关推断正确的是( )
A.若该溶液中HA电离能力大于A-水解能力,则有c(Na+)>c(A-)>c(HA)>c(H+)>c(OH-)
B.若该溶液中A-水解能力大于HA电离能力,则有c(A-)>c(HA)>(Na+)>c(OH-)>c(H+)
C.无论该溶液呈酸性还是碱性,都有c(Na+)+c(H+)=c(A-)+c(OH-)
D.无论该溶液呈酸性还是碱性,都有c(Na+)=c(A-)+c(HA)
乙酸乙酯能在多种条件下发生水解反应:CH3COOC2H5+H2O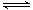 CH3COOH+C2H5OH已知该反应的速率随c(H+)的增大而加快。图为CH3COOC2H5的水解速率随时间的变化图。下列说法中正确的是( )
CH3COOH+C2H5OH已知该反应的速率随c(H+)的增大而加快。图为CH3COOC2H5的水解速率随时间的变化图。下列说法中正确的是( )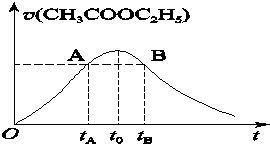
A.反应初期水解速率增大可能是溶液中c(H+)逐渐增大所致
B.A、B两点表示的c(CH3COOC2H5)相等
C.图中t0时反应达到平衡状态
D.tB时CH3COOC2H5的转化率低于tA时CH3COOC2H5的转化率
下列说法正确的是( )
| A.一定温度下,反应MgCl2(l) =Mg(l)+Cl2(g)的ΔH < 0、ΔS > 0 |
B.水解反应NH4++H2O NH3·H2O+H+达到平衡后,升高温度平衡逆向移动 NH3·H2O+H+达到平衡后,升高温度平衡逆向移动 |
| C.铅蓄电池放电时的负极和充电时的阳极均发生还原反应 |
| D.对于反应2H2O2===2H2O+O2↑, 加入MnO2或升高温度都能加快O2的生成速率 |
室温下向10 mL pH = 3的醋酸溶液中加水稀释后,下列说法正确的是( )
| A.溶液中导电粒子的数目减少 |
| B.溶液中C(CH3COO-)/C(CH3COOH).c(OH-)不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10 mL pH = 11的NaOH溶液,混合液pH=7 |