已知电离平衡常数:H2CO3>HClO>HCO3—,下列有关叙述中,正确的是:
①若KI溶液中混有Br-,加入足量FeCl3溶液,用CCl4萃取后,取无色的水层并加入AgNO3溶液,有淡黄色沉淀生成。
②向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2===2Fe3++2Cl-
③向NaClO溶液中通入少量二氧化碳的离子反应方程式:
2ClO-+CO2+H2O===2HClO+CO32—
④海水提溴过程中,用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为
3 Br2+6 CO32-+3H2O="5" Br-+ BrO3-+6HCO3-
| A.②④ | B.①③ | C.②③ | D.①④ |
下列物质中能与新制氢氧化铜悬浊液反应生成砖红色沉淀的是()
| A.乙醇 | B.乙酸 | C.乙酸乙酯 | D.葡萄糖 |
下列常见金属的冶炼原理中不合理的是( )
| 金属 |
冶炼原理 |
|
| A |
Fe |
Fe2O3+3CO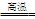 2Fe+3CO2 2Fe+3CO2 |
| B |
Hg |
2HgO 2Hg+O2↑ 2Hg+O2↑ |
| C |
Mg |
2MgO(熔融) 2Mg+O2↑ 2Mg+O2↑ |
| D |
Na |
2NaCl(熔融) 2Na+Cl2↑ 2Na+Cl2↑ |
制取一氯乙烷,采用的最佳方法是()
| A.乙烷和氯气取代反应 | B.乙烯和氯气加成反应 |
| C.乙烯和HCl加成反应 | D.乙烷和HCl作用 |
对于可逆反应2SO2+O2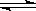 2SO3,在混合气体中充入一定量的18O2,足够长的时间后,18O原子()
2SO3,在混合气体中充入一定量的18O2,足够长的时间后,18O原子()
| A.只存在于O2中 | B.只存在于O2和SO3中 |
| C.只存在于O2和SO2中 | D.存在于O2、SO2和SO3中 |
下列反应中,属于氧化还原反应同时又是吸热反应的是
| A.Ba(OH)2·8H2O与NH4Cl反应 | B.灼热的炭与CO2反应 |
| C.铝与稀盐酸 | D.甲烷与O2的燃烧反应 |