等质量的CuO和MgO粉末分别在相同体积的硝酸中完全溶解,得到的Cu(NO3)2和Mg(NO3)2溶液的浓度分别为a mol·L-1和bmol·L-1,则a与b的关系为
| A.a=b | B.a=2b | C.2a=b | D.a=5b |
下列关于杂化轨道的叙述中,不正确的是
| A.杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对 |
| B.分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构 |
| C.杂化前后的轨道数不变,但轨道的形状发生了改变 |
| D.sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180° |
以下有关元素性质的说法不正确的是
| A.具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p3③1s22s22p2④1s22s22p63s23p4原子半径最大的是① |
| B.具有下列价电子排布式的原子中,①3s23p1②3s23p2③3s23p3④3s23p4,第一电离能最大的是③ |
| C.①Na、K、Rb ②O、S、Se ③Na、P、Cl,元素的电负性随原子序数增大而递增的是③ |
| D.某元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+ |
下列叙述中,正确的是
| A.在一个基态多电子的原子中,可以有两个运动状态完全相同的电子 |
| B.在一个基态多电子的原子中,不可能有两个能量完全相同的电子 |
| C.在一个基态多电子的原子中,M层上的电子能量肯定比L层上的电子能量高 |
D.某基态原子错误的核外电子排布图为 该排布图违背了泡利原理 该排布图违背了泡利原理 |
下列有关化学用语正确的是
| A.26Fe的价层电子排布式为3d64s2 |
| B.35Br的电子排布式可简写为[Ar]4s24p5 |
C.NH4Cl的电子式为 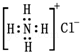 |
D.氯离子结构示意图为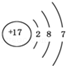 |
碱性硼化钒(VB2)—空气电池工作时反应为:4VB2 + 11O2 = 4B2O3 + 2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是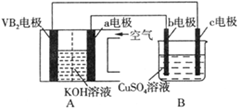
| A.VB2电极发生的电极反应为:2VB2 + 11H2O - 22e- = V2O5 + 2B2O3 + 22H+ |
| B.外电路中电子由c电极流向VB2电极 |
| C.电解过程中,b电极表面先有红色物质析出,然后有气泡产生 |
| D.若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.05 mol/L |