将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)组成的混合气体共0.8 mol,这些气体恰好能被500 mL 2 mol/L NaOH溶液完全吸收,生成NaNO3和NaNO2的混合溶液,其中生成的NaNO3的物质的量为(已知NO+NO2+2NaOH===2NaNO2+H2O,2NO2+2NaOH===NaNO3+NaNO2+H2O)
| A.0.2 mol | B.0.4 mol | C.0.6 mol | D.0.8 mol |
强酸与强碱的稀溶液发生中和反应的热化学方程式为:
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3kJ/mol,分别向1 L 0.5mol/L的NaOH溶液中加入:①稀醋酸;②浓H2SO4;③稀硝酸。恰好完全反应时的热效应分别为ΔH1、ΔH2、ΔH3,它们的关系正确的是( )
| A.ΔH1>ΔH2>ΔH3 |
| B.ΔH2>ΔH3>ΔH1 |
| C.ΔH1=ΔH2=ΔH3 |
| D.ΔH1>ΔH3>ΔH2 |
铜锌原电池(如下图)工作时,下列叙述正确的是 ()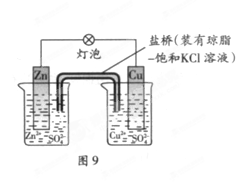
| A.正极反应为:Zn—2e-=Zn2+ |
| B.电池反应为:Zn+Cu2+=Zn2+ +Cu |
| C.在外电路中,电子从正极流向负极 |
| D.盐桥中的K+移向ZnSO4溶液 |
已知反应A2+B2===2AB,破坏1 mol A2中的化学键消耗的能量为Q1 kJ,破坏1 mol B2中的化学键消耗的能量为Q2 kJ,形成1 mol AB中的化学键释放的能量为Q3 kJ,则下列说法正确的是( )
| A.若该反应为吸热反应,则Q1+Q2<2Q3 |
| B.若该反应为放热反应,则Q1+Q2>Q3 |
| C.若A2和B2的总能量之和小于生成的AB的总能量,则反应放热 |
| D.若A2和B2的总能量之和大于生成的AB的总能量,则反应放热 |
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右下图所示。常温下,S2Cl2遇水易发生反应,并产生能使品红褪色的气体。下列说法错误的是()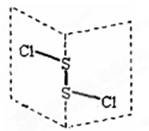
A.S2Cl2的电子式为 |
| B.S2Cl2同时含有极性键和非极性键 |
| C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2 > S2Cl2 |
| D.S2Cl2与H2O反应的化学方程式可能为: |
2S2Cl2+2H2O = SO2↑+3S↓+4HCl
铊盐与氰化钾被列为A级危险品,铊(Tl)与铝同主族,Tl3+与Ag在酸性介质中发生反应:Tl3+ +2Ag===Tl+ +2Ag+且已知Ag+ +Fe2+===Ag+Fe3+,则下列推断正确的是( )
| A.Tl+最外层有3个电子 | B.氧化性:Tl3+>Ag+>Fe3+ |
| C.Tl(OH)3与Al(OH)3相似,也是两性氢氧化物 | D.铊位于第五周期ⅢA族 |