A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系: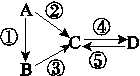
图G52
(1)若A是淡黄色固体,C、D是氧化物,C是造成酸雨的主要物质,但C也有其广泛的用途,写出其中的2个用途:__________________________。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,写出该反应的化学方程式:__________________________________。
(3)若D物质具有两性,②、③反应均要用强碱溶液,④反应时通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置:__________________。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式:____________________。D的化学式是______。
(5)若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写出该反应的离子方程式:_______________________________。
A和B是具有相同碳原子数的一氯代物,A-I转换关系如图所示: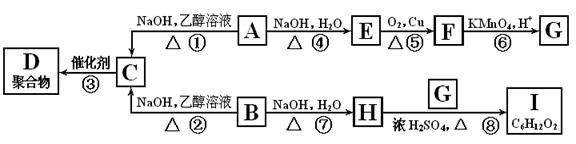
根据框图回答下列问题;
(1)B的结构简式是;
(2)反应③的化学方程式是;
(3)上述转换中属于取代反应的是;(填写反应序号)
(4)图中与E互为同分异构体的是;(填化合物代号)。图中化合物带有的含氧官能团有种。
(5)C在硫酸催化下与水反应的化学方程式是;
(6)I的结构简式是;名称是。
 以黄铁矿为原料生产硫酸的工艺流程图如下:
以黄铁矿为原料生产硫酸的工艺流程图如下:

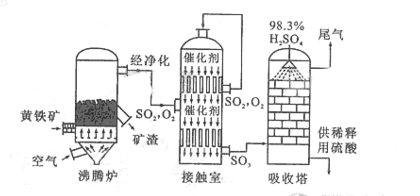

 (1)将燃烧黄铁矿的化学方程式补充完整
(1)将燃烧黄铁矿的化学方程式补充完整 4+11
4+11
 (2)接触室中发生反应的化学方程式是。
(2)接触室中发生反应的化学方程式是。 (3)依据工艺流程图判断下列说法正确的是(选填序号字母)。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)。 a. 为使黄铁矿充分燃烧,需将其粉碎
a. 为使黄铁矿充分燃烧,需将其粉碎 b. 过量空气能提高
的转化率
b. 过量空气能提高
的转化率 c. 使用催化剂能提高
的反应速率和转化率
c. 使用催化剂能提高
的反应速率和转化率 d. 沸腾炉排出的矿渣可供炼铁
d. 沸腾炉排出的矿渣可供炼铁 (4)每160g
气体与
(4)每160g
气体与 化合放出260.6
的热量,该反应的热化学方程是。
化合放出260.6
的热量,该反应的热化学方程是。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的
和铵盐。 ①
既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的
。
吸收
的离子方程式是。
①
既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的
。
吸收
的离子方程式是。 ② 为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00
相同浓度的
溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
② 为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00
相同浓度的
溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。 部分测定结果;
部分测定结果; 铵盐质量为10.00
和20.00
时,浓硫酸增加的质量相同;铵盐质量为30.00
时,浓硫酸增加的质量为0.68
;铵盐质量为40.00
时,浓硫酸的质量不变。
铵盐质量为10.00
和20.00
时,浓硫酸增加的质量相同;铵盐质量为30.00
时,浓硫酸增加的质量为0.68
;铵盐质量为40.00
时,浓硫酸的质量不变。 计算:该铵盐中氮元素的质量分数是%; 若铵盐质量为15.00
。 浓硫酸增加的质量为。 (计算结果保留两位小数)
计算:该铵盐中氮元素的质量分数是%; 若铵盐质量为15.00
。 浓硫酸增加的质量为。 (计算结果保留两位小数)
丙烯可用于合成是杀除根瘤线虫的农药(分子式为
)和应用广泛的
树脂;


 已知脂与酯克发生如下酯交换反应:
已知脂与酯克发生如下酯交换反应: (
代表羟基)
(
代表羟基) (1)农药
分子中每个碳原子上均连有卤原子。
(1)农药
分子中每个碳原子上均连有卤原子。 ①
的结构简式是
①
的结构简式是 含有的官能团名称是;
含有的官能团名称是; ②由丙烯生成A的反应类型是
②由丙烯生成A的反应类型是 (2)
水解可得到
,该水解反应的化学方程式是。
(2)
水解可得到
,该水解反应的化学方程式是。 (3)
蒸汽密度是相同状态下甲烷密度的6.25倍,
中各元素的质量分数分别为碳60%,氢8%,氧32% ,
的结构简式是。
(3)
蒸汽密度是相同状态下甲烷密度的6.25倍,
中各元素的质量分数分别为碳60%,氢8%,氧32% ,
的结构简式是。 (4)下列说法正确的是(选填序号字母)
(4)下列说法正确的是(选填序号字母) a.能发生聚合反应,还原反映和氧化反映
a.能发生聚合反应,还原反映和氧化反映 b.
含有两个甲基的羟酸类同分异构体有4个
b.
含有两个甲基的羟酸类同分异构体有4个 c
催化加氢的产物与B具有相同的相对分子质量
c
催化加氢的产物与B具有相同的相对分子质量 d E有芳香气味,易溶于乙醇
d E有芳香气味,易溶于乙醇 (5)
的水解产物经分离子最终的到甲醇和
,二者均可循环利用
树脂的制备。其中将甲醇与
分离的操作方法是
(5)
的水解产物经分离子最终的到甲醇和
,二者均可循环利用
树脂的制备。其中将甲醇与
分离的操作方法是 (6)
的分子式为
单体为苯的二元取代物,且两个取代基部处于对位,该单体苯环上的一溴取代物只有两种。D和F反应生成
单体的化学方程式。
(6)
的分子式为
单体为苯的二元取代物,且两个取代基部处于对位,该单体苯环上的一溴取代物只有两种。D和F反应生成
单体的化学方程式。
下图表示有关物质(均由短周期元素形成)之间的转化关系,其中
为常见的金属单质,
为非金属单质(一般是黑色粉末),
是常见的无色无味液体,
是淡黄色的固体化合物。(反应条件图中已省略。)

 (1)
、
、
、
代表的物质分别为、、、(填化学式);
(1)
、
、
、
代表的物质分别为、、、(填化学式); (2)反应①中的
、
均过量,该反应的化学方程式是;
(2)反应①中的
、
均过量,该反应的化学方程式是; (3)反应②中,若
与
物质的量之比为4∶3,
分别是、(填化学式);
(3)反应②中,若
与
物质的量之比为4∶3,
分别是、(填化学式); (4)反应③产物中
的化学式为;
(4)反应③产物中
的化学式为; (5)反应④的离子方程式为。
(5)反应④的离子方程式为。
均为有机化合物,它们之间的转化如下图所示:

实验表明:①
既能发生银镜反应,又能与金属钠反应放出氢气: ②核磁共振氢谱表明
分子中有三种氢,且其峰面积之比为1:1:1;
②核磁共振氢谱表明
分子中有三种氢,且其峰面积之比为1:1:1; ③
能使溴的四氯化碳溶液褪色;④1
与足量金属钠反应可放出22.4
氢气(标准状况)。
③
能使溴的四氯化碳溶液褪色;④1
与足量金属钠反应可放出22.4
氢气(标准状况)。 请根据以上信息回答下列问题:
请根据以上信息回答下列问题: (1)
的结构简式为(不考虑立体结构),由
生成
的反应类型是反应;
(1)
的结构简式为(不考虑立体结构),由
生成
的反应类型是反应; (2)
的结构简式为;
(2)
的结构简式为; (3)由
生成
的化学方程式为,
中官能团有(填名称),与
具有相同官能团的
的同分异构体还有(写出结构简式,不考虑立体结构);
(3)由
生成
的化学方程式为,
中官能团有(填名称),与
具有相同官能团的
的同分异构体还有(写出结构简式,不考虑立体结构); (4)
的结构简式为;
(4)
的结构简式为; (5)由
(5)由 生成
的化学方程式。
生成
的化学方程式。