下列各组离子在指定溶液中能大量共存的是
| A.在无色溶液中: Na+、Cu2+、NO3- 、MnO4- |
| B.在含有HCO3-的溶液中:H+、K+、SO42-、Cl- |
| C.PH=1的溶液中:Na+、 K+、AlO2-、SO42- |
| D.常温下,水电离的c(H+)=10-12mol·L-1的溶液中:K+、Ba2+、NO3-、Cl- |
设NA为阿伏加德罗常数,下列说法中正确的是()
| A.1000mL0.1mol/L 的NaCl溶液中,Na+与Cl-离子总数为0.2NA |
| B.2NA个二氧化碳分子的质量为44g |
| C.NA个氢气分子所占的体积为22.4L |
| D.17g氨气中所含原子数为NA |
下列实验操作或仪器的使用图示中正确的是()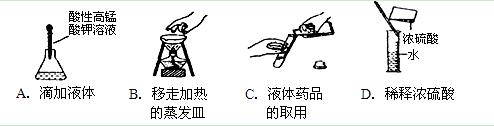
两个容积相同的容器中,一个盛有CO 气体,另一个盛有N2气。在同温同压下,两容器内的气体一定具有相同的:①分子数 ②原子数 ③质量 ④质子数 ⑤电子数 ( )
| A.只有①② | B.只有①②③ | C.只有①②④ | D.全部 |
下列实验操作中有错误的是()
| A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| B.萃取时,用酒精萃取碘水中的碘 |
| C.蒸馏时,冷却水应从冷凝管的下口通入,上口流出 |
| D.把几滴FeCl3饱和溶液滴入250mL的沸水中加热至液体呈红褐色制取Fe(OH)3胶体 |
下列有关气体的叙述中,正确的是()
| A.不同的气体,若体积不同,则它们所含的分子数也不同 |
| B.只有在标准状况下,气体的摩尔体积才能约是22.4L·mol-1 |
| C.一定温度和压强下,各种气态物质的体积大小由构成气体的分子大小决定 |
| D.一定温度和压强下,各种气态物质的体积大小由构成气体的分子数决定 |