实验室里通常用MnO2与浓盐酸反应制取氯气。现用下列有关装置先制取干燥、纯净的氯气。后进行有关性质实验。试根据下列有关装置回答有关问题。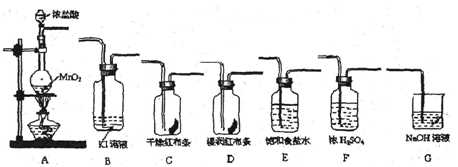
(1)上述装置中各仪器从左至右的连接顺序为A接 接 接 接 接 接G。
(2)E装置的作用是 ,D中的现象为 ,
B中的现象为________________________。
(3)写出相关反应的离子方程式:A中 ,
G中 。
(4)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3- 物质的量之比为1:1的混合液,反应的化学方程式是______________________________________。
(5) 报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)_______________________________________。
某化学课外研究小组拟对一种焰火原料(由两种短周期中的常见金属元素的单质组成的合金粉末)进行探究,请完成下列探究报告。
【探究目的】探究该焰火原料的成分
【资料检索】
(1)Mg2+检验方法:取2滴待测液,加入2滴2 mol·L-1NaOH溶液,再加入2滴镁试剂(1)染料(对硝基苯偶氮苯二酚)。若出现沉淀并吸附镁试剂(I)染料呈天蓝色,表示待测液中含有Mg2+。(注:Ag+、Cu2+、Fe3+、NH4+会妨碍Mg2+的检测)
(2)Mg(OH)2可溶于浓的氯化铵溶液,其他的常见不溶性碱难溶于氯化铵溶液。
【实验探究】
(1)甲同学进行了初步实验,实验步骤和实验现象如下,请填写下表:
(2)乙同学取甲同学第②组实验所得的溶液,加入2滴NaOH溶液及镁试剂(Ⅰ)染料,未见天蓝色物质。他得出合金中不含镁的结论,乙同学的结论(选填“正确”或“错误”),你的理由是。
(3)丙同学设计实验方案,确定焰火原料中的金属种类,实验记录如下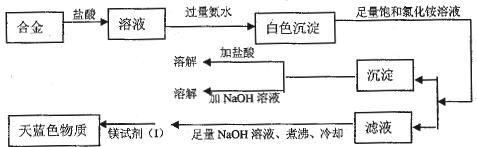
由丙同学的实验记录可知该焰火原料是由和两种金属组成的合金;
实验中滤液加入足量氢氧化钠溶液后需煮沸的理由。
(13分) 某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去):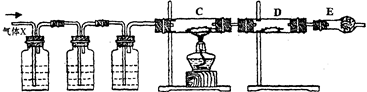
A KMnO4溶液 B
试回答:
(1)上述反应中生成二氧化硫的化学方程式为 ______________;
(2)乙同学认为还可能产生氢气的化学方程式是;
(3)丙同学在安装好装置后,必不可少的一步操作是:;
(4)A中加入的试剂可能是,作用是_____;
B中加入的试剂可能是,作用是 ___________;
E中加入的试剂可能是,作用是 ___________。
(5)可以证明气体X中含有氢气的实验现象是:
C中:_____________________;D中:_____________________________
(共14分)用18mol/L的浓硫酸配制3mol/L的稀硫酸100mL,按正确的操作顺序,将序号
填入括号内并填写下列空格。
( )用少许蒸馏水洗涤小烧杯,将洗涤液沿_______注入__________并重复2次。
( )将浓硫酸沿烧杯壁慢慢注入盛有少量蒸馏水的小烧杯中,并用玻璃棒不断搅拌。
( )用量筒取浓硫酸______mL。
( )将容量瓶盖紧摇匀。
( )将已冷却的硫酸溶液沿________注入________中。
( )改用胶头滴管加蒸馏水,使溶液凹液面最低处恰好与刻度线相切。
( )继续向容量瓶内小心加蒸馏水,直至接近刻度线__________cm处。
若实验遇到下列情况,对所配溶液中硫酸的物质的量浓度有何影响(填偏高、
偏低、无影响)。
(1)用量筒量取浓硫酸时俯视刻度线___________;
(2)稀释过程中不慎有硫酸液滴溅出____________;
(3)未将洗涤液加入容量瓶___________;
(4)定容时仰视刻度线__________;
(5)摇匀后发现凹液面下降,又加蒸馏水至刻度线__________;
(6)配制前容量瓶用水洗涤后未进行干燥处理__________。
文献资料显示某地区的酸雨主要为硫酸型和盐酸型酸雨。某兴趣小组对酸雨进行实验研究。
(1)提出合理的假设:该酸雨中的溶质除H2SO4、HC1外,该小组同学根据硫酸型酸雨的形成过程,预测主要溶质还一定有。
(2)设计实验方案验证以上假设。在答题卡上写出实验步骤、预期现象和结论。
限选试剂及义器:盐酸、硝酸、BaC12溶液、Ba(OH)2溶液、AgNO3溶液、紫色石蕊试液、品红溶液、烧杯、试管、胶头滴管。
(3)酸雨部分组成测定:
①滴定:准确量取25.00mL该酸雨于锥形瓶中,加入几滴淀粉溶液,将0.02000mol·L—1 碘水装入50mL酸式滴定管,滴定终点现象为,记录数据,重复滴定2次,平均消耗碘水VmL。
②计算:被碘水氧化的物质的物质的量浓度之和为(只列出算式,不做运算)
用硝酸氧化淀粉水解的产物(C6H12O6)可制得少量草酸,装置如图A所示(加热、搅拌和仪器固定装置均已略去):已知硝酸氧化淀粉水解液过程中可发生下列反应: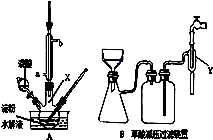
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
实验过程如下:
将1∶1的淀粉水乳液与少许硫酸(98%)加入烧杯中,
水浴加热至85℃~90℃,保持30 min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入容器X中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体。
请回答下列问题:
(1)容器X的名称:。
(2)冷凝管水的进口是(填a或b);冷凝管冷凝回流的主要物质是 。
(3)实验中若混酸滴加过快,将导致草酸产量下降,其原因是。
(4)该装置最大的一个缺点是 。
(5)草酸重结晶的减压过滤装置如图B。仪器Y接在水龙头上,其作用是 。
减压过滤的操作有:①将含晶体的溶液倒入漏斗;②将滤纸放入漏斗并用水湿润;③打开水龙头;④关闭水龙头;⑤拆下橡皮管。正确的顺序是 。
(6) 将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸。用KMnO4标准溶液滴定,该反应的离子方程式为:
2MnO4-+ 5H2C2O4 + 6H+ = 2Mn2++ 10CO2↑+ 8H2O
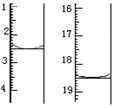
称取该样品0.12 g,加适量水完全溶解,然后用0.020 mol·L-1
的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液
颜色由变为。滴定前后滴定管中的液面读数如图所
示,则该草酸晶体样品中二水合草酸的质量分数为。