已知酸性高锰酸钾溶液可以将FeSO4氧化,方程
2KMnO4+10FeSO4+8H2SO4→K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,
现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示。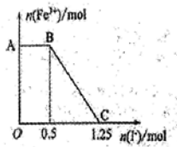
则下列有关说法错误的是
| A.图中AB段主要是高锰酸钾和碘化钾溶液反应 |
| B.图中BC段发生的反应为2Fe3++2I-= 2Fe2++ I2。 |
| C.根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25 mol |
| D.根据OC段的数据可知开始加入的硫酸亚铁的物质的量为1 mol |
钢铁常常发生两种电化学腐蚀时,下列分析正确的是
| A.负极发生的反应相同 | B.正极发生的反应相同 |
| C.酸性水膜中,正极吸收氧气反应 | D.中性水膜时,氧气发生氧化反应 |
下列食物中属于酸性食物的是
| A.西红柿 | B.牛肉 | C.海带 | D.青瓜 |
下列有关塑料问题的叙述不正确的是
| A.塑料是一种人工合成的高分子材料,具有良好的成膜性、绝缘性、耐腐蚀性能特点 |
| B.普通的塑料膜碎片在土壤中很快会被降解 |
| C.废塑料的焚烧会产生大量的污染物 |
| D.塑料的分类是回收和利用的一大障碍 |
人生病时要合理用药。下列药品与其作用匹配的是
| A.氢氧化铝:中和过多胃酸 | B.阿司匹林:消炎抗菌 |
| C.青霉素:解热镇痛 | D.医用碘酒:人体补碘 |
有关高分子材料的叙述正确的是
| A.合金属于高分子材料 | B.光导纤维属于高分子化合物 |
| C.塑料为天然高分子化合物 | D.橡胶分为天然橡胶与人工合成橡胶 |