(13分)Ⅰ:已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入足量的氯气,二者恰好完全反应。生成Cl-、ClO-、ClO3-三种含氯元素的离子,其中ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示。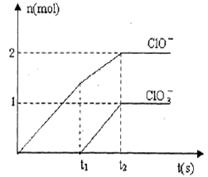
(1)t1时,开始有ClO3-生成的原因是_________________。
(2)t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为 ___________________________。
(3)该石灰乳中含有Ca(OH)2的物质的量是_________mol。
(4)若反应物的量不变,在某温度下恰好完全反应时,氧化产物比值为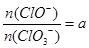 ,则n(Cl-)=____mol(用含a的代数式来表示)。
,则n(Cl-)=____mol(用含a的代数式来表示)。
Ⅱ下图中,是电解NO制备 NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3。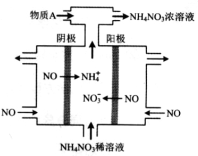
(1)阳极发生的电极反应式为 。
(2)需补充物质A,A是_____________,说明理由:________________。
向含有H2SO4的H2O2溶液中滴加定量的KMnO4溶液,反应开始时,溶液中Mn2+的浓度c将随时间的变化而变化。某学生在做实验前认为,Mn2+的浓度c与时间t的关系如下图中①,做完实验后,得到的结果为下图中②,请说明下列问题: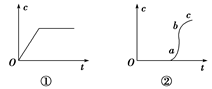
(1)写出H2O2与KMnO4反应的化学方程式。
(2)Oa段的意义。
(3)ab段的意义及ab段很陡的原因。
(4)bc段的意义。
某化学兴趣小组研究双氧水的分解时,设计了以下三组实验,每一小组取若干支试管分别加入相同体积5%的双氧水,在实验室观察气泡产生的情况。
(1)双氧水发生分解的化学方程式为
________________________________________________________________________
________________________________________________________________________。
(2)根据下表中实验操作及实验现象填写实验结论:
| 组别 |
操作 |
现象 |
实验结论 |
| 第一组 |
①向试管中加0.2 g MnO2粉末并置于盛有5 ℃水的烧杯中 |
少量气泡 |
|
| ②向试管中加0.2 g MnO2粉末并置于盛有50 ℃水的烧杯中 |
大量气泡 |
||
| 第二组 |
③向试管中加0.2 g MnO2粉末 |
大量气泡 |
|
| ④向试管中的液体中加蒸馏水稀释10倍后加0.2 g MnO2粉末 |
少量气泡 |
||
| 第三组 |
⑤向试管中加0.2 g MnO2粉末 |
大量气泡 |
|
| ⑥向试管中加5滴 FeCl3溶液 |
大量气泡 |
一定温度下,分别往容积均为5 L的甲(恒压密闭容器)、乙(恒容密闭容器)中各加入0.5 mol无色的N2O4气体,立即出现红棕色。当反应进行到2 s时,测得乙容器中N2O4的浓度为0.09 mol·L-1。经过60 s乙容器中的反应达到平衡(反应过程中两个容器的温度均保持恒定)。
(1)容器中气体出现红棕色的原因是(用化学方程式表示)
________________________________________________________________________。
(2)前2 s内,乙容器中以N2O4的浓度变化表示的平均反应速率为____________________。
(3)达到平衡时,甲容器中反应所需的时间______60 s(填“大于”、“小于”或“等于”,下同);两容器中都达到平衡时,N2O4的浓度:甲__________乙,反应过程中吸收的能量:甲__________乙。
(4)两容器都达到平衡后,若要使甲、乙中N2O4浓度相等,不能采取的措施是__________。
| A.保持温度不变,适当压缩甲容器 |
| B.保持容器体积不变,使甲容器升温 |
| C.保持容器体积和温度不变,向甲容器中加入适量N2O4 |
| D.保持容器体积不变,使甲容器降温 |
以化学平衡移动原理为依据,解释以下事实。
(1)在氨水中加入氢氧化钠溶液,有氨气逸出
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(2)合成氨工业中将氨气液化,可以提高氨的产量
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(3)用热水溶解碳酸钠晶体(Na2CO3·10H2O),可提高去污能力
________________________________________________________________________
________________________________________________________________________。
(4)打开冰冻啤酒倒入玻璃杯,杯中立即泛起大量泡沫
________________________________________________________________________
________________________________________________________________________。
在密闭容器中进行下列反应CO2(g)+C(s) 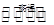 2CO(g) ΔH>0,达到平衡后,改变下列条件,则指定物质的浓度及平衡如何变化。
2CO(g) ΔH>0,达到平衡后,改变下列条件,则指定物质的浓度及平衡如何变化。
(1)增加C的用量,平衡__________,c(CO)________。
(2)减小密闭容器的体积,保持温度不变,则平衡____________,c(CO2)________。
(3)通入N2,保持密闭容器的体积和温度不变,则平衡____________,c(CO2)________。
(4)保持密闭容器的体积不变,升高温度,则平衡____________,c(CO2)________。