有机化合物A~H的转换关系如下所示: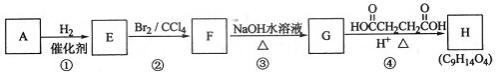
请回答下列问题:
(1)链烃A有支链且只有一个官能团,其相对分子质量在65~75之间,1 mol A完全燃烧消耗7 mol氧气,则A的结构简式是 ,名称是
(2)在特定催化剂作用下,A与等物质的量的H2反应生成E。由E转化为F的化学方程式是
(3)G与金属钠反应能放出气体,由G转化为H的化学方程式是
(4)①的反应类型是 ;③的反应类型是
(5)链烃B是A的同分异构体,分子中的所有碳原子共平面,其催化氢化产物为正戊为烷,写出B所有可能的结构简式
(6)C也是A的一种同分异构体,它的一氯代物只有一种(不考虑立体异构),则C的结构简式为 。
已知A为一种盐,隔绝空气加热的条件下发生下述变化,C、D、F、N、O为无色气体,E常温常压下为无色无味的液体,N、H、L为常见的单质,I为常见的无氧强酸,M的焰色反应为紫色,反应①常用于气体F的检验。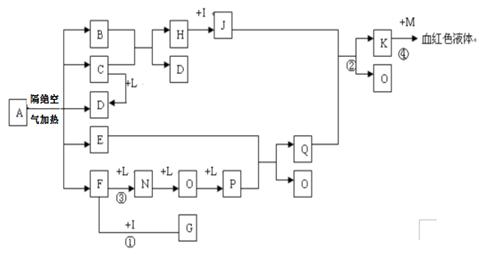
(1)写出G的电子式____________________,M的化学式_________________。
(2)写出反应②的离子反应方程式_________________________________。
(3)写出反应③的化学反应方程式_______________________,反应①—④中属于非氧化还原反应的是_______________。
(4)用石墨电极电解溶液K时,电解初始阶段电极反应方程式为:
阴极:___________________________
阳极:__________________________________
(5)已知A在隔绝空气条件下分解产生的各产物的物质的量之比为
B:C:D:E:F=1:2:2:1:2,写出A分解的化学反应方程式____________________________。
(10分)碳酸铈[Ce2(CO3)3]为白色粉末,难溶于水,主要用作生产铈的中间化合物。它可由氟碳酸铈精矿经如下流程。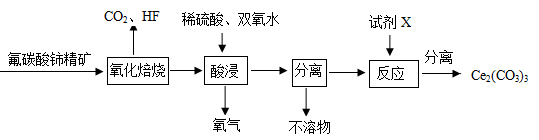
(1)氟碳酸铈的化学式为为CeFCO3,该化合物中,Ce的化合价为。
(2)氧化焙烧生成的铈化合物为二氧化铈(CeO2),其在酸浸时发生反应的离子方程式为。
(3)试剂X是。
(4)若试剂X改为氢氧化钠溶液,则反应生成难溶物—一氢氧化铈(Ⅲ),其暴露于空气中时变成紫色,最终变成黄色的氢氧化高铈(Ⅳ)。氢氧化铈在空气中被氧化成氢氧化高铈的化学方程式为。
(5)取(4)中得到的Ce(OH)4产品(质量分数为97%)1. 00 g,加硫酸溶解后,用0.1000mol·L-1的FeSO4溶液滴定至终点(铈被还原成Ce3+),则需要滴加标准溶液的体积为mL。
(12分)已知:①苯和卤代烃在催化剂作用下可以生成烷基苯和卤化氢。例如: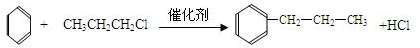
②苯的同系物(如甲苯、乙苯等)能被酸性高锰酸钾氧化为苯甲酸,例如: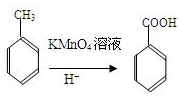
根据以下转化关系(生成物中所有无机物均已略去),回答下列问题: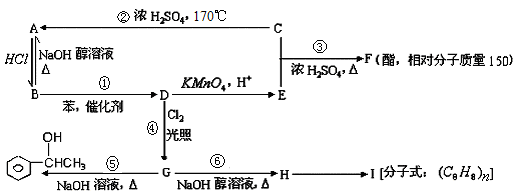
(1)D的结构简式为。
(2)E中所含官能团的名称是,反应⑥的反应类型是。
(3)写出③的反应方程式。
写出H→I的反应方程式。
(4)验证G中含有氯元素的所需要的试剂是。
(5)F的同分异构体中符合①②③条件的共有种,其中核磁共振氢谱为6组峰,且峰面积之比为3:2:2:1:1:1的为(写结构简式)
①能发生银镜反应,②能与FeCl3溶液发生显色反应 ③含有一个甲基
(10分)电子级钴的氧化物用于半导体工业和电子陶瓷等领域,是一种纯度很高的氧化物。其工业制取流程如下:
(1)滤渣A的成分除过量的Co3(PO4)2和Fe(OH)3外还有(填化学式)。
(2)加入Co3(PO4)2的目的是__________________。
(3)Co与稀硝酸反应生成Co2+的离子方程式为。
(4)滤渣B经过反复洗涤、干燥后,进行灼烧,其热重分析图如下:
写出B点物质的化学式:__________,C点物质的化学式:________________。
有A、B、C三种可溶性盐,阴、阳离子各不相同,其阴离子的摩尔质量按A、B、C的顺序依次增大。将等物质的量的A、B、C溶于水,所得溶液中只含有Fe3+、K+、SO42-、NO3-、Cl-五种离子,同时生成一种白色沉淀。请回答下列问题:
(1)经检验,三种盐中还含有下列选项中的一种离子,该离子是________(填字母序号)。
A.Na+B.Mg2+C.Cu2+D.Ag+
(2)三种盐中A的化学式。
(3)不需要加入任何试剂(“能”或“不能”)将上述三种盐溶液区分开来。
(4)若将A、B、C三种盐按一定比例溶于水,所得溶液中只含有Fe3+、SO42-、NO3-、K+四种离子且物质的量之比依次为1∶2∶3∶4,则A、B、C三种盐的物质的量之比为________。