可用下图所示装置制取、净化、收集气体的是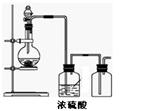
| A.锌和稀硫酸反应制氢气 |
| B.浓氨水与氧化钙固体反应制氨气 |
| C.亚硫酸钠固体与较浓硫酸反应制二氧化硫 |
| D.铜与稀硝酸反应制一氧化氮 |
在容积不变的密闭容器中存在如下反应2SO2(g)+O2(g) 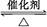 2SO3(g) ΔH<0,某研究小组研究了其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
2SO3(g) ΔH<0,某研究小组研究了其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是( )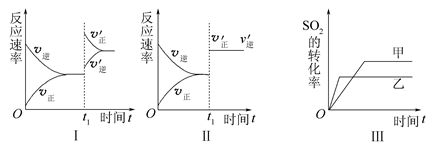
| A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响 |
| B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响 |
| C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙的高 |
| D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 |
在25mL碱式滴定管中盛放KOH溶液,将溶液的凹面调至“0”刻度后,再把其中的液体全部放出,则流出液体体积( )
| A.25mL | B.大于25mL | C.小于25mL | D.都不正确 |
反应2SO2+O2 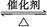 2SO3经一段时间后,SO3的浓度增加了0.8 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为( )。
2SO3经一段时间后,SO3的浓度增加了0.8 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为( )。
| A.0.1 s | B.2.5 s | C.5 s | D.10 s |
在一定温度下,反应A2(g)+B2(g)  2AB(g)达到平衡的标志是()
2AB(g)达到平衡的标志是()
| A.单位时间内消耗n mol A2,同时生成2n mol AB |
| B.容器内总压强不随时间改变 |
| C.单位时间内生成2n mol AB同时生成n mol B2 |
| D.任何时间内A2、B2的物质的量之比为定值 |
下列液体pH>7的是( )
| A.人体血液 | B.蔗糖溶液 | C.橙汁 | D.胃液 |