汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3 = K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol,则下列判断错误的是
| A.有0.250 mol KNO3被氧化 |
| B.生成44.8 L N2(标准状况) |
| C.转移电子的物质的量为1.25 mol |
| D.被氧化的N原子的物质的量为3.75 mol |
下列叙述正确的是
| A.将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀, |
| B.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解 |
| C.纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO4固体;速率不改变. |
| D.向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失 |
下表中评价合理的是
设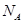 表示阿伏加德罗常数的值,下列叙述正确的是
表示阿伏加德罗常数的值,下列叙述正确的是
A.1.7gH2O2中含有的中子数目为0.9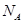 |
B.1molNa2O2固体中含离子总数为4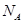 |
C.标准状况下,0.1molCl2溶于水,转移电子数目为0.1 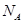 |
D.25℃,pH=13的NaOH溶液中含有OH-的数目为0.1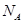 |
下列与化学概念有关的说法正确的是
| A.化合反应均为氧化还原反应 |
| B.金属氧化物均为碱性氧化物. |
| C.催化剂能改变可逆反应达到平衡的时间 |
| D.石油是混合物,其分馏产品汽油为纯净物 |
下列有关溶液中粒子浓度的关系式正确的是
| A.25℃时,0.1 mol·L-1pH=4.5的NaHC2O4溶液:c(HC2O4-)>c(H2C2O4)>c(C2O42-) |
| B.向0.2 mol·L-1 NaHCO3溶液中加入等体积的0.1 mol·L-1NaOH溶液:c(H+)+c(Na+)=c(OH-)+c(CO32-)+-c(HCO3-) |
| C.常温下,NH4Cl和NH3·H2O的混合溶液[pH=7,c(C1-)=0.l mol/L]中:c(Cl-)>c(NH4+)>c(OH-)=c(H+) |
| D.浓度均为0.1 mol·L-1的CH3COONa和CH3COOH的混合溶液中:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |