16O和18O是氧元素的两种核素,NA表示阿伏加德罗常数,下列说法正确的是
| A.16O2与18O2互为同分异构体 |
| B.16O与18O核外电子排布方式不同 |
| C.通过化学变化可以实现16O与18O间的相互转化 |
| D.标准状况下,1.12 L 16O2和1.12 L 18O2均含0.1NA个氧原子 |
碘与氢气反应的热化学方程式是
①I2(g)+H2(g) 2HI(g)ΔH=-9.48 kJ·mol-1②I2(s)+H2(g)
2HI(g)ΔH=-9.48 kJ·mol-1②I2(s)+H2(g) 2HI(g)ΔH="+26.48" kJ·mol-1下列说法正确的是( )
2HI(g)ΔH="+26.48" kJ·mol-1下列说法正确的是( )
| A.从上述两反应可知1mol的I2(g)能量比1mol的I2(s)能量高 |
B.I2(s) I2(g) ΔH<0 I2(g) ΔH<0 |
| C.②的反应物总能量与①的反应物总能量相等 |
| D.1 mol I2(g)中通入1 mol H2(g),发生反应时放出的热量为9.48 kJ·mol-1 |
下图有关电化学的示意图正确的是()
如图由锌—铜—稀H2SO4组成的原电池装置中,当导线中有0.2 mol电子通过时,理论上两极的变化是()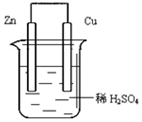
| A.铜片增重6.4g | B.锌片增重6.5 g |
| C.铜片上析出0.1 mol O2 | D.锌片溶解了6.5 g |
下列表述中正确的是( )
A.已知2H2(g)+O2(g) 2H2O(g) ΔH=-483.6 kJ/mol,则1mol氢气燃烧放出热量为483.6 kJ 2H2O(g) ΔH=-483.6 kJ/mol,则1mol氢气燃烧放出热量为483.6 kJ |
B.由C(石墨,s) C(金刚石,s) ΔH="+11.9" kJ·mol-1可知,石墨比金刚石稳定 C(金刚石,s) ΔH="+11.9" kJ·mol-1可知,石墨比金刚石稳定 |
C.同温同压下,H2(g)+Cl2(g) 2HCl(g)在光照和点燃条件的ΔH不同 2HCl(g)在光照和点燃条件的ΔH不同 |
| D.化学变化不一定都伴随着能量的变化 |
已知化学反应A2(g)+B2(g)===2AB(g) ΔH= Q kJ·mol-1,
其能量变化如图所示,则Q的值正确的是()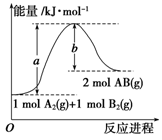
| A.a-b | B. a |
| C.-b | D. b-a |