(2014)次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:
(2)H3PO2及NaH2PO2)均可将溶液中的银离子还原为银单质,从而可用于化学镀银。
①(H3PO2)中,磷元素的化合价为
②利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4︰1,则氧化产物为: (填化学式)
③NaH2PO2是正盐还是酸式盐? 其溶液显 性(填弱酸性、中性、或者弱碱性)
(3)(H3PO2)的工业制法是:将白磷(P4)与氢氧化钡溶液反应生成PH3气体和Ba(H2PO2),后者再与硫酸反应,写出白磷与氢氧化钡溶液反应的化学方程式:
(4)(H3PO2)也可以通过电解的方法制备。工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
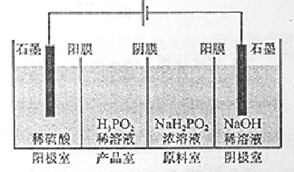
①写出阳极的电极反应式
②分析产品室可得到H3PO2的原因
③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是 杂质。该杂质产生的原因是:
某短周期元素原子最外层电子数为次外层的2倍,其单质甲可发生: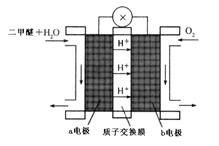
甲+乙 丙+丁+水。
丙+丁+水。
(1)若丙为NO2。
①甲与乙反应的化学方程式为 。
② NO2可作火箭重要燃料—肼(N2H4)的助燃剂。N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ·mol-1,2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H=—1135.7 kJ·mol-1,写出肼(N2H4)燃烧生成氮气和水蒸气的热化学方程式:。
③二甲醚(CH3OCH3)也被称为21世纪的新型燃料,在未来可能替代汽油、液化气、煤气等,“二甲醚燃料电池”是一种绿色电源,其工作原理如图所示。b电极是极,写出a电极上发生的电极反应式。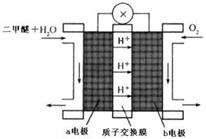
(2)若丙为SO2。
①把乙滴入硫酸铜晶体,观察到的现象是。
②完成SO2使KMnO4褪色的离子方程式:
MnO4- +SO2 +=Mn2+ +SO42- +H+
③一定条件下:2SO2(g)+O2(g) 2SO3(g) △H<0。反应的平衡常数表达式K=;反应达平衡时,若改变其中一个条件x,则符合图中曲线的是
2SO3(g) △H<0。反应的平衡常数表达式K=;反应达平衡时,若改变其中一个条件x,则符合图中曲线的是
a.x表示温度,y表示n(SO2) b.x表示压强,y表示SO2的转化率
c.x表示n(SO2),y表示n(O2) d.x表示n(SO3),y表示化学平衡常数K
A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,E(C4H8O2)是具有果香气味的液体。A、B、C、D在一定条件下有如下转化关系(部分反应条件、产物被省略)。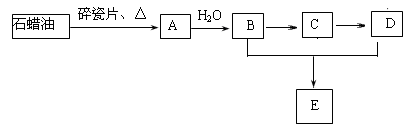
⑴A→B的反应类型是_______________;B、D中官能团的名称分别是_______、________;
⑵写出反应B→C的化学方程式:_______________________________________。
⑶丁烷是由石蜡油获得A的过程中的中间产物之一,它的一种同分异构体中含有三个甲基,则这种同分异构体的结构简式:_________________________。
⑷人在做过剧烈运动后,有一段时间腿和胳膊感到有酸胀或疼痛的感觉。原因之一是 。已知乳酸分子中含有与B、D中相同的官能团,且有一个甲基,则乳酸的结构简式是,90 g乳酸与足量金属钠完全反应产生的气体在标准状况下的体积是L
。已知乳酸分子中含有与B、D中相同的官能团,且有一个甲基,则乳酸的结构简式是,90 g乳酸与足量金属钠完全反应产生的气体在标准状况下的体积是L
在实验室我们也可以用下图所示的装置制取乙酸乙酯。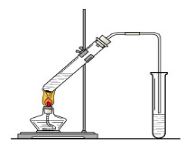
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是。
(2)写出制取乙酸乙酯的化学方程式。
(3)饱和碳酸钠溶液的主要作用除了吸收乙酸和乙醇外,还有。
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,其目的是。
(5)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是。
下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
(1)在这些元素中,化学性质最不活泼的是:(填具体元素符号或化学式,下同)。
(2)各元素最高价氧化物的水化物中,酸性最强的是_______,碱性最强的是_______。
(3)写出④与⑤的最高价氧化物对应水化物互相反应的离子方程式__________ _。
(4)用电子式表示元素④与⑥形成的化合物:
(5)表示③与①最高价态形成的化合物结构式,
(6)写出元素②的最高价氧化物的水化物和它的气态氢化物反应的化学方程式
(7)③、⑥二种元素形成的氢化物沸点较高的是(用化学式表示),其原因是。
将下列物质中,找出合适的序号填在对应的空格内
①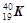 和
和 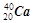 ; ②白磷与红磷 ③16O与18O ; ④O2与O3;
; ②白磷与红磷 ③16O与18O ; ④O2与O3;
⑤甲醇(CH3OH)和乙二醇(HO—CH2—CH2—OH); ⑥甲烷与丁烷;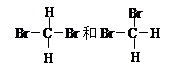 ⑦CH3-CH2-O-CH2-CH3与CH3CH2CH2CH2OH; ⑧胆矾与蓝矾
⑦CH3-CH2-O-CH2-CH3与CH3CH2CH2CH2OH; ⑧胆矾与蓝矾
⑨ 氯气和氯水⑩
注意:以上十组物质,不一定是每组物质都能找到对应填空
(1)互为同素异形体的是(填编号,下同)。
(2)互为同位素的是
(3)互为同分异构体的是(4)互为同系物的是