三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化。制三氯化铬的流程如下: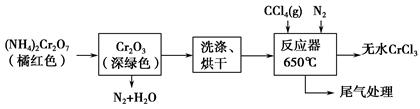
(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤,如何用简单方法判断其已洗涤干净?_____________________________。
(2)已知CCl4沸点为76.8 ℃,为保证稳定的CCl4气流,适宜的加热方式是________________。
(3)用下图装置制备CrCl3时,反应管中发生的主要反应为Cr2O3+3CCl4=2CrCl3+3COCl2,则向三颈烧瓶中通入N2的作用为①____________________________;②________________________________。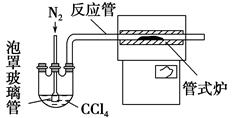
(4)样品中三氯化铬质量分数的测定:称取样品0.330 0 g,加水溶解并定容于250 mL容量瓶中。移取25.00 mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1 g Na2O2,充分加热煮沸,适当稀释,然后加入过量2 mol·L-1 H2SO4至溶液呈强酸性,此时铬以Cr2O存在,再加入1.1 g KI,加塞摇匀,充分反应后铬以Cr3+存在,于暗处静置5 min后,加入1 mL指示剂,用0.025 0 mol·L-1标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液24.00 mL。已知:
2Na2S2O3+I2=Na2S4O6+2NaI
①该实验可选用的指示剂名称为________,判定终点的现象是_______________________________________________________;
②加入Na2O2后要加热煮沸,其主要原因是____________________________;
③加入KI时发生反应的离子方程式为_______________________________;
④样品中无水三氯化铬的质量分数为________。(结果保留一位小数)
(共12分)(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出257.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
①反应的热化学方程式为。
②又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是kJ。
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g)△H=—24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g)△H=—47.4kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g)△H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________
(9分) 在一定体积的密闭容器中,进行如下可逆化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=;
(2)能判断该反应是否达到化学平衡状态的依据是(多选扣分)。
A.容器中压强不变 B.混合气体中 c(CO)不变
C.V正(H2O)= V逆(H2O) D.c(CO2)= c(CO)
(3) 800℃时,反应CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K=。
CO2(g)+H2(g)的平衡常数K=。
(1)已知1.0mol·L—1NaHSO3溶液的pH为3.5,则此溶液离子浓度从大到小的顺序为
(用离子符号表示)。
(2)能证明Na2SO3溶液中存在水解平衡SO32-+H2O HSO3-+OH-的事实是(填序号)。
HSO3-+OH-的事实是(填序号)。
A.滴入酚酞溶液变红,再加入H2SO4溶液红色退去
B.滴入酚酞溶液变红,再加入氯水后红色退去
C.滴入酚酞溶液变红,在加入BaCl2溶液后产生沉淀且红色退去
(3)工业上利用催化氧化反应将SO2转化为SO3:2SO2+ O2 2SO3。若某温度下,此反应的起始浓度c(SO2)=1.0mol·L—1,c(O2)=1.5mol·L—1,达到平衡后,SO2的转化率为50%,则此温度下该反应的平衡常数K=。
2SO3。若某温度下,此反应的起始浓度c(SO2)=1.0mol·L—1,c(O2)=1.5mol·L—1,达到平衡后,SO2的转化率为50%,则此温度下该反应的平衡常数K=。
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:2IO3-+5SO32-+2H+=I2+5SO42-+H2O。生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间衡量该反应的速率。某同学设计实验如下表所示:
| 0.01mol/LKIO3酸性溶液(含淀粉)的体积/mL |
0.01mol·L-1 Na2SO3溶液的体积/mL |
H2O的体积/mL |
实验温度 /℃ |
溶液出现蓝色时所需时间/s |
|
| 实验1 |
5 |
V1 |
35 |
25 |
|
| 实验2 |
5 |
5 |
40 |
25 |
|
| 实验3 |
5 |
5 |
V2 |
0 |
表中V2=___________mL,该实验的目的是____________________。
“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用。试回答下列问题:
(1)高炉炼铁是CO气体的重要用途之一,其基本反应为:FeO(s)+CO(g) Fe(s)+CO2(g) ΔH>0。已知在1100℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0。已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值(填“增大”、“减小”或“不变”);
②1100 ℃时测得高炉中,c(CO2)="0.025" mol·L-1,c(CO)="0.1" mol·L-1,则在这种情况下,该反应向进行(填“左”或“右”),判断依据是。
(2)目前工业上也可用CO2生产燃料甲醇,有关反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
①该反应的化学平衡常数表达式为;
②反应达到平衡时,氢气的转化率 α(H2)=;
③反应达到平衡后,下列措施能使 增大的是(填序号)。
增大的是(填序号)。
A升高温度B再充入H2C再充入CO2
D 将H2O(g)从体系中分离 E.充入He(g)
已知某溶液中只存在OH-、H+、NH4+、Cl- 四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)
②c(NH4+)>c(OH-)>c(Cl-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解一种溶质,则该溶质是(填化学式),上述四种离子浓度的大小顺序为(填序号),用离子方程式表示呈现该顺序的原因 。
(2)若四种离子的关系符合③,则溶质为(填化学式);若四种离子的关系符合④,则溶质为
(填化学式);
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)c(NH3•H2O)(填“>”或“<”或“=”,下同),混合前酸中的c(H+)碱中c(OH-);
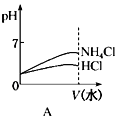
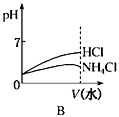
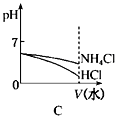
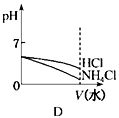
(4)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,下列图象正确的是(填选项)。