(2014)合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g) 2NH3(g) ∆H=—92.4kJ•mol‾1
2NH3(g) ∆H=—92.4kJ•mol‾1
一种工业合成氨的简易流程图如下:
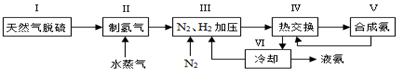
(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式: 。
(2)步骤II中制氯气原理如下:
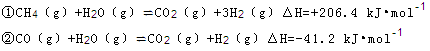
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是 。
a.升高温度 b.增大水蒸气浓度
c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18mol CO、CO2和H2的混合气体,则CO转化率为 。
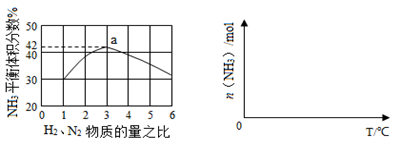
(3)下左图表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数: 。
(4)依据温度对合成氨反应的影响,在下右图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是(填序号) ,简述本流程中提高合成氨原料总转化率的方法: 。
试设计一套实验方案验证某白色粉末是纯碱。
2001年7月,有五只被人废弃的装金属钠的铁桶漂浮在珠江上,其中两只发生了剧烈爆炸,当时爆炸产生的白烟内还有许多没有燃烧的残渣,飘到附近后沉降下来,一遇到水就不停地冒泡,有时甚至还会突然着火。另外的三只被有关部门成功打捞。
(1)写出残渣遇水反应的主要化学方程式。
(2)如果你是现场工作人员,你能否用所学化学知识分析,这三只桶打捞上船后应采取什么应急处理措施?
(1)Na2CO3固体中混有少量NaHCO3固体,除去的方法是_____________,化学方程式为______________________________________________。
(2)NaHCO3溶液中混有少量Na2CO3,除去的方法是____________________,反应的离子方程式为_________________________________________。
(3)NaOH溶液中混有少量Na2CO3,除去的方法是_______________________,反应的离子方程式为_________________________________________。
(4)CO2中混有少量的SO2,除去的方法是________________________,反应的化学方程式为_____________________________________。
已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。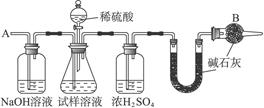
主要实验步骤如下:
①按图组装仪器,并检验装置的气密性。
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液。
③称量盛有碱石灰的U形管的质量,得到b g。
④从分液漏斗滴入一定浓度的稀硫酸,直到不再产生气体时为止。
⑤从导管A处缓缓鼓入一定量的空气。
⑥再次称量盛有碱石灰的U形管的质量,得到c g。
⑦重复步骤⑤和⑥的操作,直到U形管的质量基本不变,为d g。
请填空和完成问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明________________________。
(2)装置中干燥管B的作用是_____________________________________________________。
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果____________(填“偏高”“偏低”或“不变”)。
(4)步骤⑤的目的是__________________________。
(5)步骤⑦的目的是__________________________。
(6)该试样中纯碱的质量分数的计算式为_____________。
(7)还可以用其他实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法。
有一包白色固体,可能含有Na+、K+、Ca2+、Cu2+、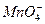 、Cl-、
、Cl-、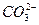 ,现做如下实验:
,现做如下实验:
①将少量固体放入水中,搅拌,静置,得无色溶液且底部有白色沉淀。
②过滤,向沉淀中加盐酸,沉淀全部溶解并产生气体。
③取少量滤液,加入AgNO3溶液有白色沉淀产生,再加稀HNO3,沉淀部分溶解并有气体放出。
请完成下列问题:
(1)白色固体中一定含有的离子是____________,一定没有的离子是_________________。
(2)白色固体中可能含有的离子是___________________,如检验其是否存在,还需进行的实验操作是_____________________________________________________________________。