在体积恒定的密闭容器中,一定量的SO2与1.100molO2在催化剂作用下加热到600℃发生反应:2SO2 + O2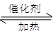 2SO3,ΔH<0。当气体的物质的量减少0.315mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是
2SO3,ΔH<0。当气体的物质的量减少0.315mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是
| A.当SO3的生成速率与SO2的消耗速率相等时反应达到平衡 |
| B.降低温度,正反应速率减小程度比逆反应速率减小程度大 |
| C.将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为161.980g |
| D.达到平衡时,SO2的转化率为90% |
某同学组装了如图所示的电化学装置,电极Ⅰ为Zn,其他电极均为Cu,则下列说法正确的是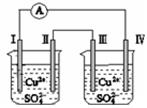
| A.电子移动:电极Ⅰ→电极Ⅳ→电极Ⅲ→电极Ⅱ |
| B.电极Ⅰ发生还原反应 |
| C.电极Ⅳ逐渐溶解 |
| D.电极Ⅲ的电极反应:Cu-2e-=Cu2+ |
常温下用石墨作电极,电解100ml 0.1mol/L的硝酸铜和0.1mol/L的硝酸银组成的混合溶液,当阴极上生成的气体体积为0.112L时(标准状况),假设溶液体积不变,下列说法正确的是
| A.阳极上产生0.025mol的O2 |
| B.电解过程中总共转移0.2mol的电子 |
| C.所得溶液中的C(H+)=0.3mol/L |
| D.阴极增重1.08g |
下列反应没有涉及原电池的是
| A.生铁投入稀盐酸中 |
| B.铜片与银片用导线连接后,同时插入FeCl3溶液中 |
| C.纯锌投入硫酸铜溶液中 |
| D.含铜的铝片投入浓硫酸中 |
以石墨棒作电极,电解CuCl2溶液,若电解时转移的电子数是3.01×1023,则此时在阴极上析出的的铜的质量是
| A.8g | B.16g | C.32g | D.64g |
下列关于原电池的叙述中错误的是
| A.构成原电池的正极和负极必须是两种不同的金属 |
| B.原电池产生电流的实质是电极上进行的氧化还原反应中会有电子的转移 |
| C.在原电池中,电子流出的一极是负极,发生氧化反应 |
| D.原电池放电时,电流的方向是从正极到负极 |