利用I2O5可消除CO污染或定量测定CO,反应为:
5CO(g)+I2O5(s) 5CO2(g)+I2(s);ΔH 1
5CO2(g)+I2(s);ΔH 1
(1)已知:2CO(g)+O2(g) 2CO2(g);ΔH 2
2CO2(g);ΔH 2
2I2(s)+5O2(g) 2I2O5(s);ΔH3,则ΔH 1= (用含ΔH 2和ΔH 3的代数式表示)。
2I2O5(s);ΔH3,则ΔH 1= (用含ΔH 2和ΔH 3的代数式表示)。
(2)不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入2molCO,测得CO2的体积分数φ(CO2)随时间t变化曲线如图。请回答:

①从反应开始至a点时的反应速率为v(CO)= ,b点时化学平衡常数Kb= 。
②d点时,温度不变,若将容器体积压缩至原来的一半,请在图中补充画出CO2体积分数的变化曲线。
③下列说法正确的是 。(填字母序号)
| A.容器内气体密度不变,表明反应达到平衡状态 |
| B.两种温度下,c点时体系中混合气体的平均相对分子质量相等 |
| C.增加I2O5的投料量有利于提高CO的转化率 |
| D.b点和d点的化学平衡常数:Kb<Kd |
(3)将500mL(标准状况)含有CO的某气体样品通过盛有足量I2O5的干燥管,170℃下充分反应,用水—乙醇液充分溶解产物I2,定容到100mL。取25.00mL,用0.0100mol·L-1 Na2S2O3标准溶液滴定,消耗标准溶液20.00mL,则样品气中CO的体积分数为 。(已知:气体样品中其他成分与I2O5不反应;2Na2S2O3+I2=2NaI+Na2S4O6)
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意图如下:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
Fe+2Fe3+=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的杂质,还可制得钛白粉。已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+ Fe3++3H2O的平衡常数K=。
Fe3++3H2O的平衡常数K=。
(4)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是(只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用方法。
| TiCl4 |
SiCl4 |
|
| 熔点/℃ |
-25.0 |
-68.6 |
| 沸点/℃ |
136.4 |
57.6 |
以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下: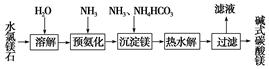
(1)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的Ksp=1.8×10-11,若溶液中c(OH-)=3.0×10-6 mol·L-1,则溶液中c(Mg2+)=。
(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式
(3)高温煅烧碱式碳酸镁得到MgO。取碱式碳酸镁4.66 g,高温煅烧至恒重,得到固体2.00 g和标准状况下CO2 0.896 L,通过计算确定碱式碳酸镁的化学式。
(4)若热水解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数(填“升高”、“降低”或“不变”)。
下表列出了某冷轧厂排放的废水中各成分的含量及国家环保标准值的有关数据:
| 冷轧含锌 废水水质 |
经处理后的水国 家环保标准值 |
|
| Zn2+浓度/(mg·L-1) |
≤800 |
≤3.9 |
| pH |
1~5 |
6~9 |
| SO42-浓度/(mg·L-1) |
≤23 000 |
≤150 |
经某一工艺处理后的废水pH=8,常温下,该废水中Zn2+的浓度为mg·
L-1(常温下,Ksp[Zn(OH)2]=1.2×10-17),(填“符合”或“不符合”)国家环保标准。
(1)在0.10 mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分
搅拌有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=mol·L-1(Ksp[Cu(OH)2]=2.2×10-20)。
(2)若在0.1 mol·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是mol·L-1。
已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)
②c(NH4+)>c(OH-)>c(Cl-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解一种溶质,则该溶质是,上述四种离子浓度的大小顺序为(填序号)。
(2)若四种离子的关系符合③,则溶质为;若四种离子的关系符合④,则溶质为。
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图像正确的是(填选项)。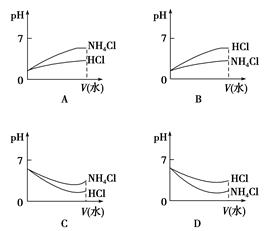
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)c(NH3·H2O)(填“大于”、“小于”或“等于”,下同);混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)c(OH-)。