工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
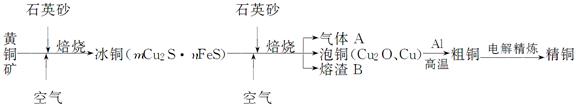
(1)气体A中的大气污染物可选用下列试剂中的 吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在 (填离子符号),检验溶液中还存在Fe2+需要加入的试剂是 。
(3)由泡铜冶炼粗铜的化学反应方程式为 。
(4)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 。
(10分)已知元素的电负性、电离能和原子半径等内容一样,也是元素的一种基本性质,
(1)下面给出14种元素的电负性:
| 元素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
| 电负性 |
1.61 |
2.04 |
1.57 |
2.55 |
3.16 |
3.98 |
0.98 |
| 元素 |
Mg |
N |
Na |
O |
P |
S |
Si |
| 电负性 |
1.31 |
3.04 |
0.93 |
3.44 |
2.19 |
2.58 |
1.90 |
试结合元素周期律知识完成下列问题:
①根据上表给出的数据,可推知元素的电负性具有的变化规律是:同周期元素从左至右,电负性逐渐,同主族元素从上至下,电负性逐渐。
②预测元素电负性的大小关系:BrI,电负性最小的元素在周期表中的位置是(放射性元素除外)。
③习惯上把SrI2作为离子化合物,把BaS作为共价化合物。(电负性Sr="0.95" I="2.66" Ba="0.89" S=2.58)我们把两成键原子的电负性差值用△X表示,用△X的数值范围可判断离子键或共价键,试判断AlBr3中化学键的类型是。
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:①原子核对核外电子的吸引力②形成稳定结构的倾向。下表是一些气态原子失去核外不同电子所需的能量:
| 锂 |
X |
Y |
|
| 失去第1个电子 |
519 |
502 |
580 |
| 失去第2个电子 |
7296 |
4570 |
1820 |
| 失去第3个电子 |
11799 |
6920 |
2750 |
| 失去第4个电子 |
9550 |
11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第2个电子时所需的能量要远远大于失去第1个电子所需的能量。
②表中X Y为第3周期元素,则X为,Y为。第3周期元素中,元素原子失去核外第一个电子需要的能量最多的是(均填元素符号)。
(9分)下表是元素周期表的一部分。表中所列的数分别代表某一种化学元素。
| ① |
② |
③ |
|||||||||||||||
| ④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||||||||||||
| ⑨ |
⑩ |
||||||||||||||||
(1)表中①-⑩化学性质最不活泼的元素,其原子结构示意图为 。
(2)表中能形成两性氢氧化物的元素是(用元素符号表示),写出该元素的氧化物与⑨最高价氧化物的水化物反应的离子方程式。
(3)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是(填化学式)。
(4)③、⑦、⑩的氢化物沸点最低的是(填化学式)。③元素与⑩元素两者核电荷数之差是。
(5)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表。
可供选择的试剂:氯水、溴水、酒精、淀粉、CCl4、NaCl溶液、NaBr溶液。
| 实验步骤 |
实验现象与结论 |
A、B、C、D、E、F、G是核电荷数依次增大的短周期主族元素,A元素原子的核外电子数、电子层数和最外层电子数均相等,元素B的一种常见单质可做惰性电极材料,C、D、G三种元素在周期表中的相对位置如图①所示,C、D、F的质子数之和等于E、G的质子数之和.E、F为金属元素,只有G元素的单质能与水反应生成两种酸。甲、乙、M、W、X、Y、Z七种物质均由A、C、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、C两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质。它们之间的转化关系如图②所示。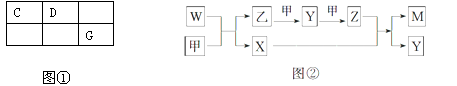
请回答下列问题:
(1)Z的化学式为___________。乙的结构式为。
(2)B的最高价氧化物的电子式为。
(3)用电子式表示A元素和E元素形成化合物的过程:____________________________。
(4)G的单质与水反应的离子方程式的________________________________________。
(5)F的单质与E的最高价氧化物的水化物反应的离子方程式为。
(6)W空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。W空气燃料电池放电时负极反应式为________________________________。
(7分)现有下列物质:①干冰;②氢氧化钠;③过氧化氢;④晶体硅;⑤过氧化钠;⑥醋酸钠;⑦溴化铵;⑧氖;⑨碘晶体;请用编号填写下列空白。
(1)只含极性键的物质有。
(2)只含非极性键的物质有。
(3)只含极性键和非极性键的物质有。
(4)只含离子键和极性键的物质有。
(5)只含离子键和非极性键的物质有。
(6)既含离子键,又含极性键和非极性键的物质有。
(7)不含化学键的物质有。
(9分)(1)周期表前20号元素中,某两种元素的原子序数相差4,周期数相差1,它们形成化合物的原子数之比为1:1。写出这些化合物的化学式。
(2)已知S2Cl2分子内所有原子的最外层均满足8电子结构,写出它的结构式。
(3)碳与它非相邻的短周期元素以极性键形成的化合物中,各原子最外层都达到了8电子稳定结构,写出其中两种化合物的化学式。
(4)1919年,Langmuir提出等电子原理:原子数相同、电子总数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。
①据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是和。
②此后,等电子原理又有所发展。例如,由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与NO2-互为等电子体的分子有:、。