(10分)已知元素的电负性、电离能和原子半径等内容一样,也是元素的一种基本性质,
(1)下面给出14种元素的电负性:
| 元素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
| 电负性 |
1.61 |
2.04 |
1.57 |
2.55 |
3.16 |
3.98 |
0.98 |
| 元素 |
Mg |
N |
Na |
O |
P |
S |
Si |
| 电负性 |
1.31 |
3.04 |
0.93 |
3.44 |
2.19 |
2.58 |
1.90 |
试结合元素周期律知识完成下列问题:
①根据上表给出的数据,可推知元素的电负性具有的变化规律是:同周期元素从左至右,电负性逐渐 ,同主族元素从上至下,电负性逐渐 。
②预测元素电负性的大小关系:Br I,电负性最小的元素在周期表中的位置是 (放射性元素除外)。
③习惯上把SrI2作为离子化合物,把BaS作为共价化合物。(电负性Sr="0.95" I="2.66" Ba="0.89" S=2.58)我们把两成键原子的电负性差值用△X表示,用△X的数值范围可判断离子键或共价键,试判断AlBr3中化学键的类型是 。
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所 需要的能量主要受两大因素的影响:①原子核对核外电子的吸引力②形成稳定结构的倾向。下表是一些气态原子失去核外不同电子所需的能量:
| |
锂 |
X |
Y |
| 失去第1个电子 |
519 |
502 |
580 |
| 失去第2个电子 |
7296 |
4570 |
1820 |
| 失去第3个电子 |
11799 |
6920 |
2750 |
| 失去第4个电子 |
|
9550 |
11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第2个电子时所需的能量要远远大于失去第1个电子所需的能量 。
②表中X Y为第3周期元素,则X为 ,Y为 。第3周期元素中,元素原子失去核外第一个电子需要的能量最多的是 (均填元素符号)。
Ⅰ.合理饮食和正确用药,是人体健康的重要保证。
现有下列五种物质A食盐;B小苏打;C苹果汁;D葡萄糖;E青霉素,请按下列要求填空(填序号)。
富含维生素C的是,可直接进入血液,补充能量的是,应用最广泛的抗生素之一的是,既可作为疏松剂,又可治疗胃酸过多的是,食用过多会引起血压升高、肾脏受损的。
Ⅱ.钢铁的生产与使用是人类文明和生活进步的一个重要标志。
(1)写出工业上用赤铁矿炼铁的主要化学反应方程式:。
(2)炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑。试回答:
①铁锅的腐蚀主要是由(填化学或电化学)腐蚀造成的。形成的铁锈的主要成分是。
②为防止轮船的船体在海水中腐蚀,一般在船身连接(填“锌块”或“铜块”)。
Ⅲ.材料是人类赖以生存和发展的重要物质基础,合理使用材料可以改善我们的生活。
(1)体育场馆建设需大量建筑材料。下列材料不属于硅酸盐材料的是(填字母)。
A.石灰石 B.水泥 C.玻璃
(2)在下列材料中,属于无机非金属材料的是(填字母)。属于塑料制品的是。
A.涤纶 B.聚氯乙烯塑料 C.氮化硅陶瓷 D.玻璃钢
(3)下列有关合金性质的说法正确的是(填字母)。
A.合金的熔点一般比它的成分金属高
B.合金的硬度一般比它的成分金属低
C.组成合金的元素种类相同,合金的性能就一定相同
D.合金与各成分金属相比,具有许多优良的物理、化学或机械性能
(4)合成塑料、合成橡胶和是常说的三大合成材料。
A、B、C、D、E、F 六种物质有如下图所示转化关系,其中物质D常温下为固体,物质E是淡黄色粉末。(部分反应物、生成物及反应条件已略去)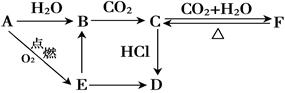
(1)写出物质A、D的化学式:A.; D.;
(2)写出下列物质转化反应的离子方程式:
B C:,
C:,
E B:,
B:,
C F:。
F:。
如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为mol•L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制480 mL物质的量浓度为0.400 mol•L-1的稀盐酸。
①容量瓶上需标有以下五项中的。
A.温度 B.浓度 C.容量 D.压强 E.刻度线
②将下列操作填写完整,并排列其正确的操作顺序(字母表示,每个字母只能用一次);
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取浓盐酸mL,注入烧杯中,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其混合均匀
C.将已冷却的盐酸沿玻璃杯注入中
D.将容量瓶盖紧,颠倒摇匀
E.改用加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面至刻度线下处。
阅读材料,回答下列问题。
材料:近年来,科技人员研究得到一种新型材料——泡沫铝。它是把发泡剂加到熔融铝合金中制成的,其优点是硬度高,密度小(约为0.16~0.5 g/cm3),比木材还轻,可浮于水面,又有很大刚性,且隔音、保温,是一种良好的建筑材料和轻质材料,近几年可大批量投放市场。
(1)下列关于泡沫铝的说法错误的是。
A.泡沫铝即是铝单质泡沫
B.泡沫铝是一种合金
C.泡沫铝是一种优质的建筑材料和轻质材料
D.泡沫铝可用于飞机制造
(2)铝制成铝箔作食品包装,是利用它的哪一性质。
A.金属光泽 B.延展性 C.导电性D.导热性
(3)铝在空气中会被氧化生成一层致密的氧化膜(氧化物)而对铝起保护作用,但这层氧化膜遇到强酸或强碱都会溶解,请写出:
①与盐酸反应的离子方程式:;
②与氢氧化钠溶液反应的离子方程式:。
选择下列实验方法分离物质,将分离方法的序号填在横线上。
A萃取分液法;B加热分解;C结晶法;D分液法;E蒸馏法;F过滤法
(1)从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
(2)分离水和汽油的混合物;
(3)分离饱和食盐水与泥沙的混合物;
(4)分离相溶的CCl4(沸点为76.75℃)和甲苯(110.6℃)的混合物;