(9分)下表是元素周期表的一部分。表中所列的数分别代表某一种化学元素。
| |
|
|
|||||||||||||||
| |
|
|
|
① |
② |
|
③ |
|
|||||||||
| |
④ |
⑤ |
|
|
⑥ |
⑦ |
⑧ |
||||||||||
| ⑨ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑩ |
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)表中①-⑩化学性质最不活泼的元素,其原子结构示意图为 。
(2)表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的氧化物与⑨最高价氧化物的水化物反应的离子方程式 。
(3)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 (填化学式)。
(4)③、⑦、⑩的氢化物沸点最低的是 (填化学式)。③元素与⑩元素两者核电荷数之差是 。
(5)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表。
可供选择的试剂:氯水、溴水、酒精、淀粉、CCl4、NaCl溶液、NaBr溶液。
| 实验步骤 |
实验现象与结论 |
| |
|
丙烷(C3H8)和丙烯(C3H6)都可作火炬燃料。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)=CH4(g)+HC CH(g)+H2(g)△H1=+156.6 kJ·mol-1
CH(g)+H2(g)△H1=+156.6 kJ·mol-1
CH3CH CH2(g)=CH4(g)+HC
CH2(g)=CH4(g)+HC CH(g ) △H2=+32.4 kJ·mol-1
CH(g ) △H2=+32.4 kJ·mol-1
则相同条件下,反应C3H8(g)= CH3CH CH2(g)+H2(g)的△H=kJ·mol-1。
CH2(g)+H2(g)的△H=kJ·mol-1。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池负极反应式为;放电时CO32-移向电池的(填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=。(已知10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=。(已知10-5.60=2.5×10-6)
(4)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中:
①c(OH-)=。
②c(H2CO3)c(CO32-)(填“>”、“=”或“<”),原因是(用离子方程式和必要的文字说明)。
芳香酯类化合物A、B互为同分异构体,均含C、H、O三种元素。相同状况下,A、B蒸气对氢气的相对密度是97,分子中C、H原子个数相同,且C、H原子数之和是O原子数的5倍。
(1)A的分子式是________________。已知:各有机物间存在如下转化关系
其中C能发生银镜反应,F经连续氧化可生成C;C与D是相对分子质量相同的不同类型的有机物。
(2)水杨酸中所含官能团的名称是____________;完全燃烧时,1 mol D与1 mol 下列有机物耗氧量相同的是____________(填字母代号)。
a.C3H6O3 b.C3H8O c.C2H4 d.C2H6O2
(3)B的结构简式是________________________;
水杨酸与小苏打溶液反应的化学方程式:___________________________;一定条件下,C与F反应的反应类型是____________。
(4)写出C与足量银氨溶液的反应化学方程式______________;反应类型是____________。
(5)同时符合下列要求的化合物有____________种。
①与A互为同分异构体
②可以水解
③苯环上有两个取代基,且苯环上的一氯代物只有1种
(6)1 mol上述(5)中的一种有机物X 在水溶液中,能与4 mol NaOH共热发生反应,写出此反应的化学方程式:____________________________________。
A、B、C、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、C同周期,A、D同主族,A、C常温下能形成两种液态化合物A2C和A2C2,E元素的周期数与主族序数相等。
请用化学用语回答下列问题:
(1)E元素在周期表中的位置为____________,请写出E最高价氧化物对应水化物的电离方程式:_________________________________。
(2)C、D、E三种元素对应简单离子半径从大到小的顺序为_____>_____>_____;
由A、B、C三种元素组成的18电子微粒的分子式为______________________。
(3)用电子式表示BC2的形成过程:_________________________________。
(4)原子序数比C小1的元素F,也能与A形成18电子的分子,已知1 mol该分子在一定条件下可以还原4 mol氧化铜,同时生成一种无污染的气体单质和红色固体还有水。请写出化学方程式_____________。
(5)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2C2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式:___________。
(6)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA, DA能与水反应放出氢气,若将1 mol DA和1 mol E单质混合加入足量的水,充分反应后生成的气体在标准状况下的体积是_________L。
重铬酸钾(K2Cr2O7)俗称红矾钾,是工业生产和实验室的重要氧化剂。已知K2Cr2O7溶液中存在平衡Cr2O72-+H2O 2CrO42-+2H+。回答下列问题(残留在溶液中的离子浓度小于1×10-5 mol·L-1时,该离子视为沉淀完全):
2CrO42-+2H+。回答下列问题(残留在溶液中的离子浓度小于1×10-5 mol·L-1时,该离子视为沉淀完全):
(1)重铬酸钾试剂标签上应标注。(填字母编号)
(2)加热时,重铬酸钾与浓盐酸反应,使氯离子氧化逸出,请写出该反应的离子方程式:。
(3)已知AgCl、Ag2CrO4(砖红色)的Ksp分别为2×10-10和1.12×10-12。分析化学中,测定含氯的中性溶液中Cl-的含量,以K2CrO4作指示剂,用AgNO3溶液滴定。滴定过程中首先析出沉淀,达到滴定终点的实验现象为:。该沉淀滴定需要注意两个问题:①指示剂的用量,滴定终点时,溶液中的CrO42-浓度为mol·L-1时合适;②控制溶液的酸度,pH在6.5-10.5之间,请结合反应方程式分析,为什么pH<6.5实验结果将不准确:。
(4)人体内铬元素的含量过高,会引起急性中毒,甚至致癌。工业上可采用铁作阳极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Fe(OH)3和Cr(OH)3沉淀,从而使废水中铬含量低于排放标准。下表是常温下金属氢氧化物的Ksp和金属离子在某浓度下开始沉淀所需的pH(表中浓度为相应pH时溶液中有关金属离子产生沉淀的最小浓度)[Cr(OH)3是一种两性氢氧化物]。
| 金属离子 |
Ksp |
pH(10-1 mol·L-1) |
pH(10-5 mol·L-1) |
| Fe3+ |
4.0×10-38 |
2.7 |
3.7 |
| Cr3+ |
6.0×10-31 |
4.3 |
5.6 |
①阴极的电极反应式为;Cr2O72-转化为Cr3 +的离子方程式为,电路中每转移6 mol电子,最多有mol Cr2O72-被还原。
②pH对废水中Cr2O72-去除效率的影响情况如图所示。电解过程中对降低废水中的铬含量最有利的pH范围为。
(12分)X、Y、Z、R为短周期元素且原子序数依次增大。X、R原子核外电子层数等于其最外层电子数,Y元素的基态原子中电子分布在3个不同的能级,且每个能级中的电子总数相同;Z的两种同素异形体都存在于大气中,对生命起着重要作用。另有M元素位于周期表的第4周期第6列。请回答下列问题:
(1)上述5种元素中,电负性最大的是(填名称),X3Z+的VSEPR模型名称是。
(2)M基态原子的电子排布式是;
(3)R的单质为面心立方最密堆积(见下图),则一个晶胞中R原子数为,R的配位数是。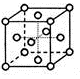
(4)已知:M2Z3与R2Z3结构和性质相似,则M2Z3溶于强碱时发生反应的离子方程式是 .