水的电离平衡曲线如图所示,下列说法不正确的是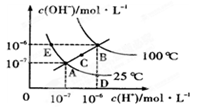
| A.图中五点KW间的关系B>C>A=D=E |
| B.若从A点到D点,可采用在水中加入少量酸的方法 |
| C.若从A点到C点,可用温度不变时在水中加入适量NH4Cl固体的方法 |
| D.若处在B点时,将pH=2的硫酸与pH=l2的KOH等体积混合后,溶液显碱性 |
向亚硫酸氢铵溶液中逐滴加入一定量NaOH溶液,以下为实验过程中发生反应的离子方程式,其中错误的是
| A.NH4++2HSO3-+3OH-® NH3·H2O+2SO32-+2H2O |
| B.NH4++HSO3-+2OH-® NH3·H2O+SO32-+H2O |
| C.2NH4++HSO3-+3OH-® 2NH3·H2O+SO32-+H2O |
| D.2NH4++5HSO3-+7OH-® 2NH3·H2O+5SO32-+5H2O |
实验室常用CuSO4溶液吸收H2S气体:CuSO4+H2S ® CuS¯+H2SO4,由该反应不能推测
| A.一定条件下弱酸可以制强酸 | B.饱和溶液中H2S比CuS提供的S2-浓度大 |
| C.CuS不溶于硫酸 | D.反应FeSO4+H2S ® FeS¯+H2SO4也能发生 |
如图所示,将铁棒和石墨棒插入饱和食盐水中。下列说法正确的是
| A.甲中铁被保护不会腐蚀 |
| B.甲中正极反应式为4OH--4e ® 2H2O+O2 |
| C.乙中铁电极上发生氧化反应 |
| D.乙中石墨电极附近滴几滴碘化钾淀粉溶液变蓝色 |
下图是部分卤素单质和XX’型卤素互化物的沸点与其相对分子质量的关系图。试推测ICl的沸点所处的最小范围是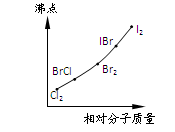
| A.Cl2至BrCl | B.BrCl至Br2 |
| C.Br2至IBr | D.IBr至I2 |
为证明CuSO4溶液显蓝色与Cu2+有关而与SO42-无关,某同学设计了以下实验,其中对实验目的没有意义的是
| A.观察硫酸溶液呈无色 |
| B.观察硫酸铜粉末呈白色 |
| C.往CuSO4溶液中滴加足量NaOH溶液,生成蓝色沉淀,过滤,滤液呈无色 |
| D.往CuSO4溶液中滴加足量Ba(NO3)2溶液,生成白色沉淀,过滤,滤液仍显蓝色 |