有4种混合溶液,分别由等体积0.1mol/L的2种溶液混合而成:①CH3COON与HCl②CH3COONa与NaOH ③H3COONa与NaCl ④H3COONa与NaHCO3。下列各项排序正确的是
| A.pH: ②>③>④>① |
| B.c(CH3COO-):②>④>③>① |
| C.溶液中c(H+): ①>③>②>④ |
| D.c(CH3COOH): ①>④>③>② |
X、Y、Z是中学化学中三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如图转化关系(未注明反应条件),下列说法不正确的是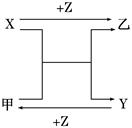
| A.若X为金属单质,Y为非金属固体单质,则Z为O2 |
| B.若X为金属单质,Y均为非金属气体单质,则乙不可能为黑色固体 |
| C.若X、Y均为非金属气体单质,则Z可能为H2 |
| D.若X、Y均为非金属固体单质,则Z可能为O2 |
下列实验能达到目的的是
| A.可以用加热的方法除去K2CO3中混有的少量NaHCO3 |
| B.某溶液先加入稀盐酸无明显现象,再加入BaCl2溶液产生白色沉淀,证明原溶液中含有SO42- |
| C.用蒸馏水润湿的pH试纸测定某酸溶液的pH |
| D.将氯水滴入品红溶液,品红溶液褪色,证明氯气与水反应的产物有漂白性 |
下列关于有机化合物的结构、性质说法正确的是
| A.乙烯、苯都可以和氢气发生加成反应,都能使酸性高锰酸钾溶液褪色 |
| B.人体内没有能使纤维素水解成葡萄糖的酶,因此纤维素不能作为人类的营养食物 |
| C.C2H4和C3H6一定互为同系物 |
| D.石油经过分馏得到多种烃,煤经过分馏可制得焦炭、煤焦油等产品 |
下列有关物质应用的说法正确的是
| A.SiO2具有导电性,可用于制造光导纤维 |
| B.体积分数为95%的酒精通常作为医用酒精 |
| C.由于铝具有强还原性,所以可以通过铝热反应冶炼某些高熔点金属 |
| D.漂白粉、漂粉精可用来漂白棉、麻、纸张,不能用作游泳池及环境的消毒剂 |
下列有关溶液中粒子浓度关系的比较中不正确的是
A.饱和氯水中滴加0.1 mol·L-1的NaOH溶液,溶液pH=7时:c(Na+)=2c(ClO-)+c(HClO)
B.已知HF的酸性比CH3 COOH的强,pH相等的NaF与CH3 COOK溶液中:c(Na+)-c(F-)=c(K+) -c(CH3COO-)
C.0.lmol/L pH为1的NaHB溶液中:c(Na+)>c(B2﹣)>c(H+)>c(OH﹣)
D.常温下,向20.00 mL 0.100 mol·L-1 NaA溶液中逐滴加入0.100 mol·L-1盐酸溶液的pH=7时:c(HA)=c(Cl-)>c(OH-)=c(H+)