(6分)选择合适的试剂(适量)对下列待提纯的物质进行除杂(括号内为杂质),并写出相应的离子方程式。
| 待提纯的物质 |
选用的试剂 |
相应离子方程式 |
| (1)CO(CO2) |
|
|
| (2) FeCl3 (FeCl2) |
|
|
| (3) Na2CO3溶液(NaHCO3) |
|
|
一切植物中均含有天然有机高分子化合物A,它是构成植物细胞壁的基础物质,不溶于水,也不溶于一般有机溶剂。能发生如下变化(A-F均分别代表一种物质,框图中的部分产物已略去)
|


图表示由元素周期表中1~20号且不同主族元素组成的单质及化合物之间转化关系(产物中的水已略去)。其中A为单质;在实验室中,常用固体B和固体C加热制取气体F;F与G的组成元素相同,G与I分子所含电子数相同。请回答: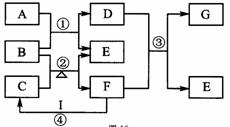
(1)写出B、G的化学式B、G。
(2)写出C的电子式;反应④的实验现象为;写出F的一种具体用
途。
(3)向具有漂白作用的D溶液加入I的稀溶液,写出反应的离子方程式:
。
向D的溶液加入I的浓溶液有A生成,其反应的离子方程式为:
。
(4)写出反应③的化学方程式。
W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水。向该盐的溶液中滴加足量的盐酸,随着盐酸的逐滴加入,所观察到的现象是,反应结束时,该反应的总反应离子方程式为。
(2)W与Y可形成化合物W2Y,该化合物的水溶液显_性,原因(用离子方程式表示)__________________________;它的水溶液中存在多种离子,请写出电荷守恒的等式。
(3)若甲为W的最高价氧化物对应的水化物,乙为Y的氢化物。
现有①0.2mol/甲的溶液和②0.2mol/L乙的溶液,则①中由水电离出c(OH-)
_____②中由水电离出的c(OH-)。(填“>”、“=”或“<”)
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为
。
从废钯催化剂(该催化剂的载体为活性炭,杂质元素有铁、镁、铝、硅、铜等)中提取海棉钯(含Pd>99.9%)的部分工艺流程如下:
将最后所得到的滤液,经过一定的操作后可得到海棉钯。
(1)废钯催化剂经烘干后,再在800℃的高温下焙烧,焙烧过程中需通入足量空气的原因是;焙烧时钯转化为氧化钯(Pd0),则甲酸还原氧化钯的化学方程式为
。
(2)钯精渣中钯的回收率高低主要取决于王水溶解的操作条件,已知反应温度、反应时间和王水用量对钯回收率的影响如图l~图3所示,则王水溶解钯精渣的适宜条件为、 、。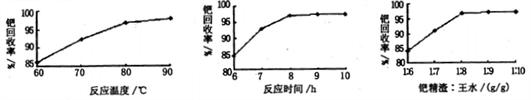
(3)王水是浓硝酸与浓盐酸按体积比1:3混合而成的,王水溶解钯精渣的过程中有化合物A和一种无色、有毒气体B生成,并得到滤渣。
①气体B的分子式:;滤渣的主要成分是。
②经测定,化合物A由3种元素组成,有关元素的质量分数为Pd:42.4%,H:0.8%,则A的化学式为。(已知Pd相对 原子质量为106)
原子质量为106)
A、B、C、D、F五种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃气体。而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊。 D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体。请回答下列问题:
(1)写出A、B、C、D、E、F的化学式
A.B.C.D.E.F.
(2)写出F和H反应的化学方程式。
(3)写出下列反应的离子方程式:D+盐酸。