化合物()在氢氧化钠溶液中加热反应后再酸化可得到化合物和.回答下列问题:
(1)的分子式为,分子中只有一个官能团.则的结构简式是
(2)是芳香化合物,相对分子质量为180,其碳的质量分数为60.0,氢的质量分数为4.4,其余为氧,则的分子式是
(3)已知的芳环上有三个取代基,其中一个取代基无支链,且还有能使溴的四氯化碳溶液褪色的官能团及能与碳酸氢钠溶液反应放出气体的官能团,则该取代基上的官能团名称是
(4)的结构简式是
利用某炉渣(只含Fe2O3、FeO、SiO2、Al2O3)可制备新型净水剂碱式氯化铝[Al2(OH)nCl6-n] 和Fe2O3。工艺流程如下:
①用3.00mol/L的盐酸稀盐酸 浸取炉渣,过滤.
浸取炉渣,过滤.
②滤液先用H2O2氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3
③将第②步分离出沉淀的滤液通CO2调pH值后,保持温度在90~100℃进行“蒸发浓缩”,可以得到碱式氯化铝[Al2(OH)nCl6-n]
据以上信息回 答下列问题:
答下列问题:
(1)实验室配制3.00mol/L的盐酸100mL需要36.5%的浓盐酸(密度为1.2g/cm 3) _____mL,配制用到的仪器有烧杯、玻璃棒、量筒、胶头滴管、。
3) _____mL,配制用到的仪器有烧杯、玻璃棒、量筒、胶头滴管、。
(2)写出H2O2与滤液反应的化学方程式
(3) “蒸发浓缩”需保持温度在90~100℃,可采用的加热方法是
(4)为验证炉渣中含有Fe2O3,做如下实验:
a取适量炉渣于烧杯中,加足量溶解、静置
b取上层清液少量于试管中,滴加,观察现象。选用提供的试剂,
提供的试剂:①稀硝酸 ②稀硫酸 ③氯水 ④ KMnO4溶液 ⑤ KSCN溶液
KMnO4溶液 ⑤ KSCN溶液
步骤a、b中所加试剂分别为;
步骤b中反应的离子方程式:
为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒剂、漂白剂等。
(1) 过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2C O3和H2O2的双重性质。过碳酸钠与下列物质均会发
O3和H2O2的双重性质。过碳酸钠与下列物质均会发 生化学反应而失效,其中过碳酸钠有发生了还原反应的是
生化学反应而失效,其中过碳酸钠有发生了还原反应的是
| A.MnO2 | B.KMnO4溶液 | C.Na2SO3溶液 | D.稀硫酸 |
(2) 漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为HClO2→ClO2↑+H++Cl-+H2O(未配平)。当生成1molClO2时转移的电子数是
(3) 二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与SO2反应制得。请写出反应的离子方程式:
(4)有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,则该反应中还原剂与氧化剂的物质的量之比为
(1)某化学反应可用下式表示:A + B ="=" C + D + H2O ,若A、D均可用于消毒,且C是家家户户的厨房必备的物质之一,
写出该反应的离子方程式:
(2)硝酸铅的稀溶液中,滴入几滴稀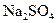 生成白色
生成白色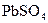 沉淀,再滴入数滴饱和NaAc溶液,微热,并不断搅动,沉淀慢慢溶解,以上发生的都是复分解反应,写出反应过程的离子方程式
沉淀,再滴入数滴饱和NaAc溶液,微热,并不断搅动,沉淀慢慢溶解,以上发生的都是复分解反应,写出反应过程的离子方程式
①②
(3)边微热边向铵明矾[NH4Al(SO4)2`12H2O]溶液中逐滴加入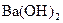 溶液至中性
溶液至中性
(提示:NH+ 4 、Al3+恰好完全反应)
①此时发生反应的离子方程式为
②向以上所得中性溶液中继续滴加稀硫酸,相关反应的离子方程式是:
硝酸与金属反应时,浓度越稀还原产物价态越低。现用一定量的铝粉与镁粉组成的混合物与100ml硝酸钾溶液与硫酸组成的混合溶液充分反应,反应过程中无任何气体放出,相反应后的溶液中逐滴加入4.00mol/L的NaOH溶液,加入的溶液体积与与产生的沉淀质量的关系如图所示。
回答下列问题:
(1)写出铝与混合溶液反应的离子方程式:
(2)参加反应硝酸根离子物质的量为mol
(3)参加反应的铝与镁的质量之比为
(4)混合液中硫酸的物质的量的浓度为mol/L
用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯。
(1)完成该反应的化学方程式:(系数按顺序填在答题卷上)
___ C+ ___ KMnO4+ ____ H2SO4→____CO2↑+ ____MnSO4 + ____K2SO4+ ____
(2)反应的氧化剂是,被还原的元素名称是;
(3)H2SO4在上述反应中表现出来的性质是(填选项编号)
| A.酸性 | B.氧化性 | C.吸水性 | D.脱水性 |
(4)上述反应中若产生2.24L(标准状况下)CO2气体,则转移的电子数是。