将0.20 mol NO和0.1 mol CO充入一个容积恒定为1L的密闭容器中发生反应:2NO(g)+2CO(g) N2(g)+2CO2(g) △H<0在不同条件下,反应过程中部分物质的浓度变化如图所示。
N2(g)+2CO2(g) △H<0在不同条件下,反应过程中部分物质的浓度变化如图所示。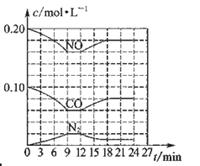
下列说法正确的是
| A.容器内的压强不发生变化说明该反应达到平衡 |
| B.当向容器中再充入0.20 mol NO时,平衡向正反应方向移动,K增大 |
| C.第12 min时改变的反应条件为减小压强 |
| D.向该容器内充入He气,容器内气体压强增大,所以反应速率增大 |
LiAlH4是金属储氢材料又是有机合成中的常用试剂,遇水能剧烈反应释放出氢气,LiAlH4在125 ℃分解为LiH、H2和Al。下列叙述错误的是( )。
| A.LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂 |
| B.LiAlH4与D2O反应,所得氢气的摩尔质量为4 g·mol-1 |
| C.1 mol LiAlH4在125 ℃完全分解,转移3 mol电子 |
| D.LiAlH4与水反应生成三种物质时,化学方程式可表示为:LiAlH4+4H2O=Al(OH)3+LiOH+4H2↑ |
将SO2通入足量Fe2(SO4)3溶液中,完全反应后再加入K2Cr2O7溶液,发生的两个化学反应为:SO2+2Fe3++2H2O=SO42—+2Fe2++W ①
Cr2O72—+aFe2++bH+―→Cr3++Fe3++H2O ②。
下列有关说法正确的是( )。
| A.还原性:Cr3+>SO2 |
| B.方程式②中,a=6,b=7 |
| C.Cr2O72—能将Na2SO3氧化成Na2SO4 |
| D.方程式①中W为OH- |
在水溶液中能大量共存的一组离子是 ( )。
| A.Na+、Ba2+、Cl-、NO3— | B.Pb2+、Hg2+、S2-、SO42— |
| C.NH4+、H+、S2O32—、PO43— | D.Ca2+、Al3+、Br-、CO32— |
有下列三个反应方程式:
①Cl2+FeI2=FeCl2+I2
②2Fe2++Br2=2Fe3++2Br-
③Co2O3+6HCl=2CoCl2+Cl2↑+3H2O,下列说法正确的是 ( )。
| A.①②③中氧化产物分别是FeCl2、Fe3+、Cl2 |
| B.根据以上反应的化学方程式可以得到氧化性强弱关系为Cl2>Co2O3>Fe3+ |
| C.在反应③中生成1 mol Cl2时,有2 mol HCl被氧化 |
| D.根据反应①②一定可以推理得到Cl2+FeBr2=FeCl2+Br2 |
现取m g镁铝合金在一定浓度的稀硝酸中恰好完全溶解(硝酸的还原产物只有NO),向反应后的混合溶液中滴加b mol·L-1 NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n g,则下列有关该实验的说法中正确的有( )。
①沉淀中OH-的质量为(n-m)g
②恰好溶解后溶液中的NO3—的物质的量为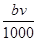 mol
mol
③反应过程中转移的电子数为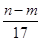 mol
mol
④标准状况下生成NO的体积为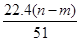 L
L
⑤与合金反应的硝酸的物质的量为(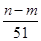 +
+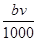 )mol
)mol
| A.5项 | B.4项 | C.3项 | D.2项 |