工业制氢气的一个重要反应是:CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
(1)已知在25℃时:
①C(石墨)+1/2O2(g)=CO(g) △H1=-111kJ·mol-1
②C(石墨)+O2(g)=CO2(g) △H2=-394kJ·mol-1
③H2(g)+1/2O2(g)=H2O(g) △H3=-242kJ·mol-1
则反应CO(g)+H2O(g) =CO2(g)+H2(g)的反应热△H=___________。
(2)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡状态所需时间/min |
||
| CO |
H2O |
H2 |
CO2 |
|||
| I |
650 |
4 |
2 |
1.6 |
1.6 |
5 |
| II |
900 |
2 |
1 |
0.5 |
0.5 |
3 |
| III |
900 |
a |
b |
c |
d |
t |
①对于反应CO(g)+H2O(g) CO2(g)+H2(g),下列说法正确的是_________
CO2(g)+H2(g),下列说法正确的是_________
A.当容器中CO的含量保持不变时,说明该反应达到平衡状态
B.若混合气体的密度不再改变,说明该反应已达化学平衡状态
C.实验I中,反应达到平衡后,再通入4molCO和2molH2O,平衡正向移动,H2的体积分数增大
D.若使用催化剂,会改变反应的途径,但反应的焓变不变
②实验I中,从反应开始到反应达到平衡时,CO的平均反应速率 (CO)=_____;
(CO)=_____;
③实验II条件下反应的平衡常数K=_____________(保留小数点后二位);若某温度T时,该反应的平衡常数为0.5,则T_____900℃(填“>”或“<”)
④实验III中,若平衡时,CO的转化率大于水蒸气,则a,b必须满足的关系是______;
⑤若在900℃时,实验II反应达到平衡后,向此容器中再加入1molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则此时v(正)_____v(逆)(填“>”或“<”),平衡向______方向移动(填“正反应”、“逆反应”或“不移动”)
⑥若仅改变温度,纵坐标y随T变化如图所示,
则纵坐标y表示的是
A.CO2的百分含量 B.混合气体的平均相对分子质量
C.CO的转化率 D.H2O的物质的量
2010年上海世博会主题是“城市,让生活更美好”,试回答下列问题:
(1)为确保世博会期间申城空气质量优良率达到95%以上,世博会期间的空气质量状况监测中,不需要监测的指标是_____________。
a.可吸入颗粒物(PM10) b.NO2浓度 c.SO2浓度 d.CO2浓度;
(2)造成臭氧层空洞的主要物质是_______________。为了改善空气质量,必须控制大气中二氧化硫、氮氧化物、烟尘等污染物的排放量。对汽车加装尾气催化净化装置,使其中的有害气体NO、CO转化为无害气体,该反应的化学方程式为__________。
(3)为2010年世博会期间提供科学有效的环境质量保障方案,白龙港污水处理厂升级改造,处理废水时加入K2SO4·Al2(SO4)3·24H2O或碱式氯化铝的作用是____________;通入臭氧或二氧化氯的作用是______________。某农村地区为获得饮用水,在将地表水取回家后,常使用漂白粉或漂白精片进行杀菌消毒,其原理可用化学方程式表示为_________________________。
(4)世博会中国馆——“东方之冠”,它由钢筋混凝土、7000多块红色铝板和1200多块玻璃等建成。生产玻璃所用的工业设备是;石英玻璃化学稳定性强、膨胀系数小,是一种特种玻璃,石英玻璃的主要成分是;
(1)某肉制品包装上印有相关配料:精选瘦肉、食盐、胭脂红、苯甲酸钠。其中属于调味剂的是,属于着色剂的是,属于防腐剂的是。
(2)亚硝酸钠有毒,其外观和咸味与食盐很相似,因此要防止因误食亚硝酸钠而发生事故。亚硝酸钠和氯化钠的部分性质如下表:
| 性质 |
亚硝酸钠 |
氯化钠 |
| 1.酸性条件下的稳定性 |
微热时分解为NO和NO2 |
微热时不分解 |
| 2.熔点 |
271℃ |
801℃ |
| 3.室温时的溶解度 |
约80g |
约35g |
①请根据表中信息设计一种鉴别NaNO2和NaCl的方法,写出简单的操作过程、现象和结论:
②碘是人体中不可缺少的(选填“常量”或“微量”)元素。
③食盐中加入碘元素能有效防止缺碘引起的疾病。以前在食盐中加入碘化钾(KI),放置一年后,碘流失约92%。现在食盐中加入碘酸钾(KIO3),在相同条件下碘仅损失约7%。食盐中加入碘化钾的碘损失率高的原因是;(填字母)。
a.碘化钾被氧化,造成碘化钾的碘损失率高。 b.碘化钾升华,造成碘化钾的碘损失率高。
c.碘化钾与食物中的成分发生反应,造成碘化钾的碘损失率高。
④萃取碘水中的碘时,一般选用的试剂是(填字母);
A.酒精 B.四氯化碳 C.乙酸
⑤可用盐酸酸化的碘化钾和淀粉溶液检验食盐中的碘酸钾。反应化学方程式为:
5KI+KIO3 + 6HCl ="=" 6KCl + 3I2 + 3H2O,反应的现象是
⑥已知碘酸钾受热易分解,你认为在用碘酸钾加碘盐进行烹饪时应注意什么问题?。
⑶糖类、油脂、蛋白质都是人体必需的营养物质。
①油脂被摄入人体后,在酶的作用下水解为高级脂肪酸和(写名称),进而被氧化生成二氧化碳和水并提供能量,或作为合成人体所需其他物质的原料。
②氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(—NH2)和 ________(写结构简式)。人体中共有二十多种氨基酸,其中人体自身_____(填“能”或“不能”)合成的氨基酸称为人体必需氨基酸。
③淀粉在淀粉酶的作用下最终水解为葡萄糖(C6H12O6),部分葡萄糖在体内被氧化生成二氧化碳和水。写出葡萄糖在体内被氧化的化学方程式:。
已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g)△H<0。现将一定量NO2和N2O4的混合气体通入体积为2L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。
N2O4(g)△H<0。现将一定量NO2和N2O4的混合气体通入体积为2L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。
(1)图中共有两条曲线X和Y,其中表示NO2浓度随时间变化的曲线是;a、b、c、d四个点中,表示化学反应处于平衡状态的点是。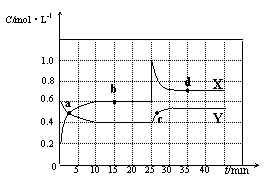
(2)①前10 min内用NO2表示的化学反应速率v(NO2)=mol·L-1·min-1。
②反应2NO2(g)  N2O4(g)在b点的平衡常数K(b)=。
N2O4(g)在b点的平衡常数K(b)=。
③反应2NO2(g)  N2O4(g)在d点的平衡常数K(d)与b点的平衡常数K(b)的关系:
N2O4(g)在d点的平衡常数K(d)与b点的平衡常数K(b)的关系:
K(d)K(b)(填“>”、“=”或“<”)。
(3)①据图分析,在25 min时采取的措施是(填序号)。
| A.加入催化剂 | B.缩小容器体积 |
| C.加入一定量的NO2 | D.加入一定量的N2O4 |
②若在35 min时,保持温度不变,快速缩小容器的体积至1 L,气体的颜色变化过程是
在25℃时,用石墨电极电解2.0L,2.5 mol/LCuSO4溶液。5 min后,在一个石墨电极上有6.4gCu生成。试回答下列问题:
(1)极发生氧化反应(填阴,阳),电极反应式为。
(2)极发生还原反应(填阴,阳),电极反应式为。
(3)有mol电子发生转移,得到氧气的体积(标准状况)是L,溶液的pH是。反应速率v(Cu2+):v(O2)==
(4)如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差g,电解液的pH(填“变小”、“变大”或“不变”)
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图所示;两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。
(1)a极是极,b极是极,
电极反应式分别为,。
(2)氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料,往往是某些碳氢化合物,如甲烷(天然气)、汽油等。请写出将图中H2换成CH4时所构成的甲烷燃料电池中a极的电极反应式:。此时电池内总的反应方程式为。