(1)已知:Fe(s)+1/2O2(g)═2FeO(s) △H1=-272.0kJ•mol-1 ①;
2Al(s)+3/2O2(g)═Al2O3(s)△H2=-1675.7kJ•mol-1 ②
Al和FeO发生铝热反应的热化学方程式是 。
(2)某可逆反应在不同条件下的反应历程分别为A、B,如图所示。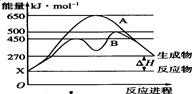
①据图判断该反应达到平衡后,其他条件不变,升高温度,反应物的转化率 (填“增大”“减小”或“不变”)。
②其中B历程表明此反应采用的条件为 (选填序号)。
A.升高温度
B.增大反应物的浓度
C.降低温度
D.使用催化剂
(3)1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g)。该反应的平衡常数表达式为 ;已知K1000℃< K1200℃,若降低体系温度,混合气体的平均相对分子质量将会 (填“增大”“减小”或“不变”)。
Na2S(s)+4H2O(g)。该反应的平衡常数表达式为 ;已知K1000℃< K1200℃,若降低体系温度,混合气体的平均相对分子质量将会 (填“增大”“减小”或“不变”)。
(4)常温下,如果取0.1 mol/LHA溶液与0.1 mol/lNaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH一浓度与0.1 mol/lNaOH溶液中由水电离出的OH一浓度之比为 。
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,
试推断(NH4)2 CO3溶液的pH (填“<”“>”或“=”)7;
相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为 (填序号)。
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
( 10分)自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:SiO2(s) +4HF(g) SiF4(g)+ 2H2O(g) ΔH =" -148.9" kJ/mol
SiF4(g)+ 2H2O(g) ΔH =" -148.9" kJ/mol
(1)在地壳深处容易有气体逸出,在地壳浅处容易有沉积。
(2)如果上述反应的平衡常数K值变大,该反应(选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,。
a.2v正(HF)=v逆(H2O) b.v(H2O)=2v(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为。
(1)氯化铝水溶液呈性(填“酸性”,“中性”或“碱性”),原因是(用离子方程式表示):。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是(写化学式)。实验室在保存AlCl3溶液时,常在溶液中加少量的,以(填“促进”、“抑制”)其水解。
(2)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈性(填“酸性”,“中性”或“碱性”),溶液中c(Na+)c(CH3COO-)(填“ >” 或“=”或“<”)。
(3)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈性,(填“酸性”,“中性”或“碱性”)溶液中c(Na+)c(CH3COO-) (填“ >” 或“=”或“<”)。
(4) 物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈性,(填“酸性”,“中性”或“碱性”),醋酸体积氢氧化钠溶液体积(填“ >” 或“=”或“<”)。
(5)已知0.1 mol·L-1的NaHCO3溶液PH=9,则溶液中c(CO32-)c(OH-) (填“ >” 或“=”或“<”),其溶液显电中性的原因(用离子浓度关系式表示)。
⑴下列物质属于非电解质的是,属于弱电解质的是(填序号)。
①氨水 ②SO2 ③CI2 ④次氯酸 ⑤BaSO4⑥乙醇 ⑦H2O ⑧NaHCO3
⑵用浓度为0.1 mol·L-1标准盐酸滴定氢氧化钠溶液时,以下操作会使结果偏低的是
(填序号)。
①锥形瓶用待测液润洗 ②酸式滴定管读数是滴前仰视滴后俯视
③配制氢氧化钠溶液时混有碳酸钠 ④酸式滴定管未用标准液润洗
(3) 向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全,写出反应的离子方程式:;此时溶液呈性(填“酸性”,“中性”或“碱性”),原因:。
在火箭推进器中装有还原剂液态肼(N2H4)和强氧化剂液态H2O2,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热量。已知一些键断裂所需能量数据:
N-N:159 kJ /mol N="N:419" kJ /mol N≡N:945 kJ /mol H-H:436 kJ /mol
N-H:389 kJ /mol H-O:465 kJ /mol O-O:138 kJ /mol O="O:498" kJ /mol
①写出肼和过氧化氢的结构式:肼_________,过氧化氢______
②写出肼和双氧水反应的热化学方程式_____________________________。
已知:⑴环己烯可以通过丁二烯与乙烯发生环化加成反应得到:
⑵实验证明,下列反应中反应物分子的环外双键比环内双键更容易被氧化: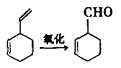
⑶R-CHO +H2 → R-CH2OH
现仅以丁二烯为有机原料,无机试剂任选,按下列途径合成甲基环己烷: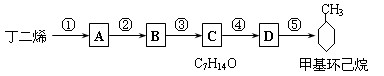
请按要求填空:
⑴A的结构简式是;B的结构简式是。
⑵写出下列反应的化学方程式和反应类型:
反应④,反应类型。
反应⑤,反应类型。