下列离子方程式书写正确的是
| A.稀硝酸溶液中加入氢氧化亚铁: Fe(OH)2 + 2H+ = Fe2++ 2H2O |
| B.NaOH溶液中加入过量Ba(HCO3)2溶液:Ba2++2OH-+2HCO3-= BaCO3↓+2H2O+ CO32- |
| C.FeI2溶液中通入极少量Cl2: 2I-+Cl2= I2+2Cl- |
| D.AlCl3溶液中加入过量氨水: Al3++4OH-=AlO2-+2H2O |
草酸(H2C2O4)是二元弱酸,草酸氢钠溶液显酸性。常温下向10mL 0.01mol/L NaHC2O4溶液中滴加0.01mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
| A.V(NaOH) = 0时,c(H+)=1×10—2mol/L |
| B.V(NaOH) <10mL时,可能存在c(Na+)=2c(C2O42-)+c(HC2O4- ) |
| C.V(NaOH) =" 10" mL时,c(H+) = 1×10—7 mol/L |
| D.V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4- ) |
下列各组热化学方程式中,Q1<Q2的是
| A.CH4(g)+2O2(g) → CO2(g)+2H2O(g)+Q1 CH4(g)+3/2O2(g) → CO(g)+2H2O(g)+Q2 |
| B.S(s)+O2(g) → SO2(g)+Q1S(g)+O2(g) → SO2(g)+Q2 |
| C.H2(g)+Br2(g) →2HBr(q) +Q1H2(g)+Cl2(g) →2HCl(q) +Q2 |
| D.HCl(aq)+NaOH(aq) → NaCl(aq)+H2O(l)+ Q1 |
CH3COOH(aq)+NaOH(aq) → CH3COONa(aq)+ H2O(l)+Q2
头孢羟氨苄(如图)被人体吸收效果良好,疗效明显,且毒性反应极小,因而被广泛适用于敏感细菌所致的各类感染病的治疗。下列对头孢羟氨苄的说法中正确的是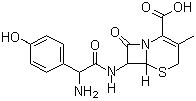 ·H2O
·H2O
| A.头孢羟氨苄的化学式为C16H16N3O5S·H2O |
| B.在催化剂存在的条件下与氢气发生加成反应,1mol头孢羟氨苄消耗7molH2 |
| C.头孢羟氨苄与氯化铁溶液混合显紫色 |
| D.头孢羟氨苄能在空气中稳定存在 |
将1.92g铜投入一定量的浓硝酸中,铜完全溶解,生成气体颜色越来越浅,共收集到672ml气体(标准状况),将盛有此气体的容器倒扣在水中,通入少量氧气,最后剩余气体224ml(标准状况)。则通入的氧气在标准状况下的体积为
| A.504ml | B.168ml | C.336ml | D.224ml |
如图利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一培养皿扣在上面。下表中对实验现象所做的解释正确的是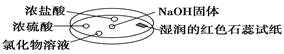
| 选项 |
实验现象 |
解释 |
| A |
浓盐酸附近产生白烟 |
NH3与HCl气体反应生成了NH4Cl固体 |
| B |
浓硫酸附近无明显现象 |
NH3与浓硫酸不发生反应 |
| C |
氯化物溶液变浑浊 |
该溶液一定是AlCl3溶液 |
| D |
湿润的红色石蕊试纸变蓝 |
NH3是一种可溶性碱 |