(16分)A、B、C、D、E、F、G七种短周期元素的原子序数依次增大,其中仅有一种稀有气体元素。A和E最外层电子数相同,短周期主族元素的原子中,E原子的半径最大;B、C和F在周期表中相邻,B、C同周期,C、F同主族,F原子的质子数是C原子质子数的2倍;A和C可形成两种常见的液态化合物X和Y(相对分子质量X<Y ),D形成的分子为单原子分子。回答问题:
(1)G元素为______(填元素符号),Y的电子式为 。
(2)液态化合物Y与稀H2SO4酸化的K2Cr2O7溶液作用可产生一种无色助燃性气体及可溶性的Cr2(SO4)3,则该反应的离子方程式为 。
(3)用某种金属易拉罐与A、C、E组成的化合物的水溶液反应,产生的气体可充填气球,请写出该反应的离子方程式 ,使用这种气球存在的隐患是 。
(4)P和Q两种物质都是由A、C、E、F四种元素组成的盐,其水溶液都显酸性,等物质的量的P和Q恰好完全反应。写出该反应的离子方程式: ,这两种盐均含有的化学键类型为 。
(5)由A、B两元素形成的化合物W可作为火箭推进器中的强还原剂,已知一个W分子和一个Y分子中都含有18个电子,0.5mol液态W和足量液态Y反应,生成一种无色无味无毒的气体B2和液态X,并放出408.8KJ热量。写出该反应的热化学方程式为 。
(10分)A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。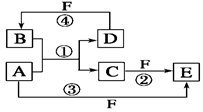
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则C的电子式为,反应④的化学方程式为_______________________________________。
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行。请写出在水溶液中进行的反应②的离子方程式;
已知光照条件下D与F反应生成B,写出该反应的化学方程式:。
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为。
15分)A为药用有机物,从A出发可发生如下图所示一系列反应。已知A在一定条件下能与醇发生酯化反应,A分子中苯环上有二个取代基,且苯环上的一卤取代物有二种,D不能与NaHCO3溶液反应,但能与NaOH溶液反应。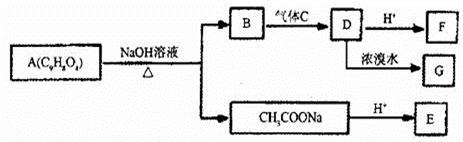
请回答下列问题:
(1)F中的含氧官能团的名称是;
(2)A在酸性条件下水解的产物能发生的反应类型有(填序号)
①取代反应;②加成反应;③消去反应;④加聚反应;⑤缩聚反应;
(3)用系统命名法命名同时符合下列条件的有机物,其名称为;
ⅰ与E的摩尔质量相同
ⅱ与NaHCO3溶液反应无气体生成,但与金属钠反应有气泡生成
ⅲ核磁共振氢谱有三组峰
(4)C的化学式为,G的结构简式为;
(5)芳香族化合物M是A的同分异构体,苯环上二个取代基在对位;M与A具有相同的官能团。但与新制的Cu(OH)2悬浊液供热有砖红色沉淀生成,其中一种符合条件的M与NaOH溶液反应的化学方程式为。
(15分) 下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| a |
|||||||||||||||||
| b |
c |
d |
e |
f |
|||||||||||||
| g |
h |
i |
j |
k |
l |
m |
|||||||||||
| n |
o |
||||||||||||||||
试回答下列问题:
(1)请写出元素O的基态原子电子排布式。
(2)c元素的一种同素异形体与熔融的n单质形成石墨间隙化合物,比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,其平面图形见图,则x值为。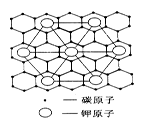
(3)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表(填元素符号);其中电负性最大的是(填图中的序号)。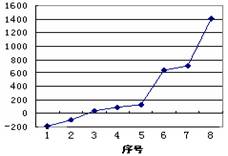
(4)由i原子跟d原子以1 : 1相互交替结合而形成的晶体,晶型与晶体j相同。则i与d形成的晶体中一个晶胞中含有4个i原子;与同一个i原子相连的d原子构成的空间构型为,d原子的杂化类型为。
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。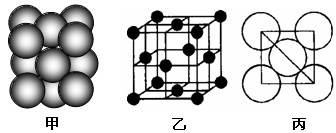
若已知i的原子半径为dcm,NA代表阿伏加德罗常数,i的相对原子质量为M,
则该晶体的密度为_______g/cm3(用字母表示)。
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。
部分含钒物质在水中的溶解性如下表所示: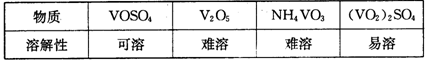
该工艺的主要流程如下:
请回答下列问题。
⑴工业上由V2O5冶炼金属钒常用铝热剂法,用化学方程式表示为。
⑵反应①的目的是。
⑶该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,写出该步发生反应的离子方程式:。
⑷用已知浓度的硫酸酸化的H2C2O4溶液,滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量:VO2++H2C2O4+H+→VO2++CO2+X。
X为(写化学式)。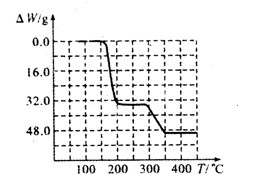
⑸经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如上图所示。则NH4VO3在分解过程中(填序号)。
| A.先分解失去H2O,再分解失去NH3 | B.先分解失去NH3,再分解失去H2O |
| C.同时分解失去H2O和NH3 | D.同时分解失去H2、N2和H2O |
过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:
已知CaO2·8H2O呈白色,微溶于水,加热至350℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是;
(2)检验“水洗”是否合格的方法是;
(3)沉淀时常用冰水控制温度在0℃左右,其可能原因是(写出两种):
①;②。
(4)测定产品中CaO2的含量的实验步骤是:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L—1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
【已知:I2+2S2O32-= 2I-+S4O62-】
①CaO2的质量分数为(用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能(填“不受影响”、“偏低”或“偏高”),原因是_______________。