已知可逆反应:M(g)+N(g) P(g)+Q(g);△H>0,请回答下列问题:
P(g)+Q(g);△H>0,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol·L-1, c(N)="2.4" mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为 。
(2)若反应温度升高,M的转化率 (填“增大”“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为:c(M)=" 4" mol·L-1,c(N)=amol·L-1;达到平衡后,c(P)="2" mol·L-1,a= 。
(4)若反应温度不变,反应物的起始浓度为:c(M)="c(N)=" bmol·L-1,达到平衡后,M的转化率为 。
在一个容积固定不变的密闭容器中进行反应:2A(g)+B(g)  3C(g)+D(s),已知将2mol A和1mol B充入该容器中,反应在某温度下达到平衡时,C的物质的量为Wmol,C在平衡混合气体中的体积分数为n%。
3C(g)+D(s),已知将2mol A和1mol B充入该容器中,反应在某温度下达到平衡时,C的物质的量为Wmol,C在平衡混合气体中的体积分数为n%。
(1)如果用下列情况的配比作起始物,在同样的容器和温度下达到平衡,其结果一定是:C的物质的量为2Wmol,C在平衡混合气体中的体积分数仍为n%的是 。
A.4mol A+2mol B
B.6mol C+1mol D
C.1mol A+0.5mol B+1.5mol C+0.5mol D
D.2mol A+1mol B+3mol C+1mol D
E.2mol A+1mol B+3mol C+2mol D
(2)若维持该题条件不变,仅从生成物开始配比,要求达到平衡时,C的物质的量仍为Wmol,则D的起始物质的量n(D)应满足的条件是 (用含W的代数式表示)。
(3)此反应的v-t图象如甲图,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如乙图,请用“=、<、>”填空:
①a1 a2;②b1 b2;③两图中阴影部分面积:甲 乙。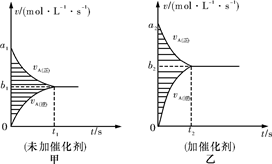
固体X是由两种常见元素组成的化合物,其中金属元素与另一元素的质量比为14∶1。在一定条件下X可发生如下框图的转化关系,有的反应标出全部产物,有的反应标出部分产物。已知P为两种气体的混合物,R是无色无味能使澄清石灰水变浑浊的气体,C为红褐色物质,M为常见金属单质,Q为常见非金属单质。试填空。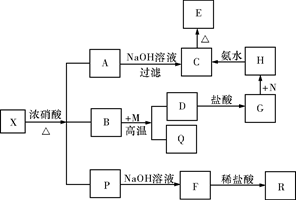
(1)X的化学式为 ,P中气体的化学式为 。
(2)实现G→H,欲不引进新的杂质,N可以选择下列物质中的 (填序号)。
①KMnO4 ②HNO3 ③H2O2 ④Cl2
(3)写出B和M反应的化学方程式: 。
(4)已知P中有一种气体与氢氧化钠溶液反应可生成两种正盐,该反应的离子方程式为 。
某班级同学查阅资料,对Na2S有了一定的认识,并提出了以下几个问题,请回答:
(1)1000℃时,在密闭容器中加入一定量的Na2SO4固体使其发生以下反应达到平衡:
Na2SO4(s)+4H2(g)  Na2S(s)+4H2O(g) ΔH>0若反应在恒温恒容状态下进行,回答以下问题:
Na2S(s)+4H2O(g) ΔH>0若反应在恒温恒容状态下进行,回答以下问题:
向容器中分别加入以下物质,判断对平衡有无影响,有影响的填写出平衡移动的方向。
①加入Na2SO4 。②加入焦炭 。
(2)向Na2S的浓溶液中逐滴加入稀盐酸,直到不再生成H2S气体为止,则在此过程中,溶液的c(HS-)变化趋势可能是 。
a.逐渐减小b.逐渐增大
c.先逐渐增大,而后减小 d.先逐渐减小,而后增大
(3)Na2S溶液与下列溶液混合,不能发生反应的是 。
①H2S ②SO2 ③Na2SO3 ④酸性KMnO4溶液 ⑤CuSO4⑥氯水
(4)写出Na2S和AlCl3溶液反应的离子方程式 。
将一定质量的Al、Fe混合物加入到足量的盐酸中,充分反应后得到标准状况下的氢气8.96L;如 果将等质量的该混合物加入到足量的NaOH溶液中,充分反应后得到标
果将等质量的该混合物加入到足量的NaOH溶液中,充分反应后得到标
准状况下的氢气6.72L。
(1)写出涉及到的化学方程式:_________ ____________________________
____________________________
(2)混合物中Al和Fe的质量分别为________和__________
(3)当混合物与盐酸反应时,转移电子数为_______mol;与NaOH溶液反应时转移电子数为_______mol。
有A、B、C、D、E 5种透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3
和AgNO3中的一种。已知:
①A和B反应有气体生成;
②B与C反应有沉淀生成
③C与D反应有沉淀生成
④D与E反应有沉淀生成
⑤A与E反应有气体生成
⑥在②和③的反应中生成的沉淀为同一种物质
(1)在②和③反应中生成的沉淀为同一种物质,其化学式为________。
(2)写出各物质的化学式:A ________、B__________、C___________、D_________、E________。.
(3)A和E反应的离子方程式为_____________________________。