铁和氧化铁的混合物共a mol,加一定量盐酸后固体全部溶解,得到的溶液中不含Fe3+,同时收集到b mol氢气,则原混合物中氧化铁的物质的量为
A.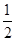 (a—b)mol B.
(a—b)mol B.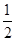 (a+b)mol
(a+b)mol
c.(a—b)mol D.b mol
下列说法中正确的是 ( )
| A.医用酒精的浓度通常为95% |
| B.单质硅是将太阳能转变为电能的常用材料 |
| C.淀粉、纤维素和油脂都属于天然高分子化合物 |
| D.合成纤维和光导纤维都是新型无机非金属材料 |
在同温同压下,某有机物和过量Na反应得到V1 L氢气,另一份等量的该有机物和足量的NaHCO3溶液反应得到V2 L二氧化碳,若V1=V2≠0,则该有机物可能是 ( )
下列各组中的反应属于同一反应类型的是 ( )
| A.由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 |
| B.由苯硝化制硝基苯;由苯与氢气反应制环己烷 |
| C.由乙酸和乙醇制乙酸乙酯;由甲酸乙酯水解制甲酸和乙醇 |
| D.由氯代环己烷消去制环己烯;由丙烯与溴反应制1 ,2二溴丙烷 |
下列每组中各有三对物质,它们都能用分液漏斗分离的是 ( )
| A.乙酸乙酯和水、乙醇和水、葡萄糖和水 |
| B.甘油和水、乙醛和水、乙酸和乙醇 |
| C.乙酸乙酯和水、溴苯和水、硝基苯和水 |
| D.乙酸和水、甲苯和水、己烷和水 |
下列说法正确的是 ( )
| A.食用白糖的主要成分是蔗糖 |
| B.小苏打的主要成分是碳酸钠 |
| C.煤气的主要成分是丁烷 |
| D.植物油的主要成分是高级脂肪酸 |