(16分)
Ⅰ.实验室常见的几种气体发生装置如图A、B、C所示:
(1)实验室可以用B或C装置制取氨气,如果用B装置制取氨气其化学反应方程式为____________________。
(2)气体的性质是选择气体收集方法的主要依据。下列性质与收集方法无关的是________________(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
(3)若用A装置与D装置相连制取并收集X气体,则X可以是下列气体中的________。
①CO2 ②NO ③Cl2 ④H2 ⑤HCl
其中在D装置中连接小烧杯的目的是____________________。
Ⅱ.某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验 。
(1)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3,钴的化合价为________,制备X的化学方程式为______________________________________;
(2)氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL cl mol·L-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。氨的测定装置(已省略加热和夹持装置)
①装置中安全管的作用原理是__________。②样品中氨的质量分数表达式为________________。
食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量 等杂质离子,实验室提纯NaCl的流程如下:
等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和 溶液饱和
溶液饱和 溶液
溶液 溶液
溶液 溶液
溶液 溶液
溶液
(1)①欲除去浊液I中的 离子,选出A所代表的试剂,按滴加顺序依次为(只填化学式),检验溶液中
离子,选出A所代表的试剂,按滴加顺序依次为(只填化学式),检验溶液中 沉淀完全的操作为。
沉淀完全的操作为。
②加盐酸的目的是(用离子方程式表示)。
③如果在实验室中完成下列过程,甲、乙两个过程均要用到玻璃棒,玻璃棒的作用分别是
甲,乙。
(2)工业上用惰性电极电解饱和食盐水制取盐酸,写出电解饱和食盐水的化学方程式;用试纸检验电解食盐水阳极产物的方法是。
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.尿素(H2NCONH2)可用于制有机铁肥,主要代表有 [Fe(H2NCONH2)6](NO3)3 [三硝酸六尿素合铁(Ⅲ)]。
⑴基态Fe3+的核外电子排布式为。C、N、O三种元素的第一电离能由大到小的顺序是。
⑵尿素分子中C、N原子的杂化方式分别是。
⑶[Fe(H2NCONH2)6](NO3)3中“H2NCONH2”与Fe(Ⅲ)之间的作用力是。与NO3—互为等电子体的一种化合物是(写化学式)。
⑷CO2和NH3是工业上制备尿素的重要原料,固态CO2(干冰)的晶胞结构如右图所示。
1个CO2分子周围等距离且距离最近的CO2分子有个。
②铜金合金的晶胞结构与干冰相似,若顶点为Au、面心为Cu,则铜金合金晶体中Au与Cu原子数之比为是。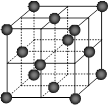
B.脱氢醋酸是一种难溶于水的低毒、高效广谱抗菌剂,可由乙酰乙酸乙酯经脱醇缩合而成,反应原理为: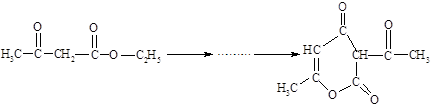
实验步骤如下:
①在反应器中加入乙酰乙酸乙酯、少量催化剂和数粒沸石,在瓶口安装分馏装置。
②低温加热(不超过85℃)60~70min;然后大火加热蒸出乙醇。
③将反应液趁热倒入烧杯中,冷却到室温,有柠檬黄色晶体析出。
④将柠檬黄色晶体转移至圆底烧瓶B中,加水15mL,滴入1滴硫酸,进行水蒸气蒸馏(如图所示)。从水蒸气蒸馏液中经抽滤可分离出脱氢醋酸,再烘干即得成品。
步骤①中加入沸石的目的是。
步骤②中,在60~70min内低温加热的目的是,然后大火加热蒸出乙醇的目的是。
步骤④中水蒸气蒸馏装置中烧瓶A的作用是,玻璃管的作用是。
用测得相对分子质量的方法,可以检验所得产物是否纯净,测得相对分子质量通常采用的仪器是。
(12分)某化学课外活动小组研究乙醇氧化的实验并验证其产物,设计了甲、乙两套装置(图中的夹持仪器均未画出,“△”表示酒精灯热源),每套装置又可划分为①、②、③三部分。仪器中盛放的试剂为:a—无水乙醇(沸点:78℃);b—铜丝;c—无水硫酸铜;d—新制氢氧化铜悬浊液。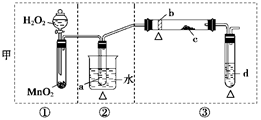
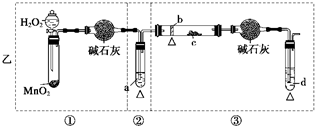
(1)简述两套方案各自的优点:
甲:__________________________________________________________________,
乙:___________________________________________________________________。
(2)集中两套方案的优点,组成一套比较合理完善的实验装置,可按气流由左至右的顺序表示为_________________________________________________________(例如甲①,乙②)。
(3)若要保证此实验有较高的效率,还需补充的仪器有________,理由_______________。
(4)实验中能验证乙醇氧化产物的实验现象是________________________________。
(5)装置中,若撤去第①部分,其它操作不变,则无水硫酸铜无明显变化,其余现象与(4)相同,推断燃烧管中主要反应的化学方程式:__________________________________。
某化学兴趣小组参考工业制硝酸的化学原理,在实验室用下列各装置进行组合来制备硝酸并验证硝酸的性质(所给装置必须用到并且只能用一次,各装置中的试剂均足量。已知常温下CaCl2能吸收氨气)。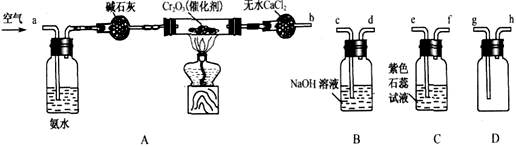
(1)装置的连接顺序为(用a、b、c、d等字母表示):b接( ),( )接( ),( )接( )。
(2)写出氨气催化氧化的化学方程式______________________;
(3)进行实验时,装置A中碱石灰的作用是_____________,D中的现象是_______________;
(4)能证明有硝酸生成的现象是__________________________________________;
(5)实验开始时,下列操作顺序最合理的是______________
a.先加热A装置中的催化剂.再由导管a通入空气
b.先由导管a通人空气,再加热A装置中的催化剂
c.在由导管a通人空气的同时,加热A装置中的催化剂
现有以下实验装置供实验时挑选使用。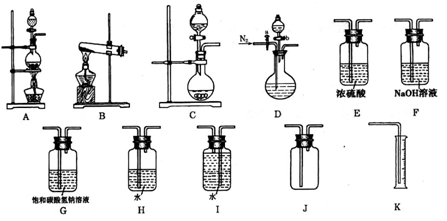
(1)利用Cu和浓硝酸反应制备NO2,用过氧化氢溶液和MnO2制取O2,根据反应原理应选用___________装置(填序号,从A、B、C中选取)。
(2)某同学设计下列四种制备NH3的方法,不合理的是_________(填序号)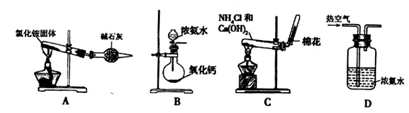
(3)欲用石灰石和浓盐酸反应制取纯净干燥的CO2气体,将你所选的仪器按气体由左向右方向连接,连接顺序为______________→G→___________________。
用饱和碳酸氢钠溶液除去挥发出的HCl优于用水除HCl的原因是_____________________
____________________________________________________。
(4)某小组为了探究Ag与浓硝酸反应过程中可能产生NO,设计了一连接顺序为D→H→I→K的实验装置。
①检验这一装置气密性的方法是________________________________________________
__________________________________________________________________________,
②反应开始前通入N2的目的是______________________________________________,
③反应结束,若H瓶中溶液体积为100mL,从中取出25.00mL溶液以酚酞作指示剂,用0.1000mol·L—1NaOH溶液进行滴定,两次滴定用去NaOH溶液的体积分别为16.98mL和17.0.2mL,则该瓶中硝酸的物质的量浓度为_________________。
若实验测得NO的体积为95.2mL(已折算成标准状况),请你通过数据说明Ag与浓硝酸反应过程中是否有NO产生____________________________________________________
___________________________________________________________________________。