【化学——选修3:物质结构与性质】
氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti2+中,电子占据的最高能层符号为_____________,该能层具有的原子轨道数为____________________。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2 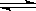 2NH3,实现储氢和输氢。下列说法正确的是________________。
2NH3,实现储氢和输氢。下列说法正确的是________________。
| A.NH3分子中氮原子的轨道杂化方式为sp2杂化 |
| B.NH4+与PH4+、CH4、BH4-、ClO4-互为等电子体 |
| C.相同压强时,NH3的沸点比PH3的沸点高 |
| D.[Cu(NH3)4]2+中,N原子是配位原子 |
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是__________________。
(4)用价层电子对互斥理论推断SnBr2分子中,Sn原子的轨道杂化方式为 ,SnBr2分子中Sn—Br的键角 120°(填“>”“<”或“=”)。
(5)NiO的晶体结构与氯化钠相同,在晶胞中镍离子的配位数是_______。已知晶胞的边长为a nm,NiO的摩尔质量为b g·mol-1,NA为阿伏加德罗常数的值,则NiO晶体的密度为_________g·cm-3。
现有A、B两种有机化合物,已知:① B分子可以看成A分子中一个氢原子被氨基取代而得到;②它们的分子中氢元素的质量分数相同,相对分子质量都不超过170,A中碳元素的质量分数为72.00%;③它们都是一取代苯,分子中都不含甲基,都含有一个羧基。
请按要求填空:
(1)A、B的分子中氢元素的质量分数都是;B的分子式为。
(2)A的结构简式是;
(3)C与A互为同分异构体,分子中也没有甲基,但苯环上有两个处于对位的取代基,能发生银镜反应,也能在一定条件下发生消去反应,则C与银氨溶液反应的化学方程式是;
(4)B有一种同分异构体D是某芳香烃发生硝化反应生成的唯一一种一硝基取代物(硝基连在苯环上),则D的结构简式是。
为了测定混有少量KCl杂质的明矾KAl(SO4)2·nH2O的纯度,同时测定 n的值,按下列流程进行实验:
n的值,按下列流程进行实验:
(1)称量样品需用托盘天平,下列有关使用托盘
天平的叙述,不正确的是 ( ).
A、称量前先调节托盘天平的零点
B、称量时左盘放被称量物,右盘放砝码
C、潮湿的或具有腐蚀性的药品,必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量
D、用托盘天平可以准确称量至0.01克
E、称量完毕,应把砝码放回砝码盒中
(2)判断已脱水至恒重的方法是()
A、长时间加热 B、两次称量的质量必须一样
C、观察有水蒸气不再冒出 D、两次称量的质量差不超过0.1g
(3)在加热结束后,冷却固体的操作为 ;
(4)A溶液是 (填化学式),判断A溶液是否足量的方法是
;
(5)通过实验,测得明矾化学式中n值为12,则明矾的纯度为 %。
(已知KAl(SO4)2·12H2O的式量为474)
氨在国民经济中占有重要地位。请回答有关氨的下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) △H=+akJ/mol
4NH3(g)+5O2(g)=4 NO(g)+6H2O(g) △H=-bkJ/mol
NO(g)+6H2O(g) △H=-bkJ/mol
2H2(g)+O2(g)=2H20(g) △H=-ckJ/mol 则N2(g)+3H2(g) 2NH3(g)的△H=;
则N2(g)+3H2(g) 2NH3(g)的△H=;
(2)在一定温度下,将3molN2气体和7molH2气体通入到体积为1L的密闭容器中。当反应达到平衡时,容器内气体的压强为起始时的80%,则其平衡常数为。改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是;
①增大压强 ②增大反应物质的浓度
③使用催化剂 ④降低温度
(3)可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成份为氯化铵)生成。该反应的化学方程式为;
(4)工业生产氨水的物质的量浓度为20mol/L,实验室若需用80mL浓度为5mol/L的氨水时,需取20mol/L的氨水mL(用100mL的容量瓶)。假如该氨水的pH=a,加入相同体积的盐酸时,两溶液恰好反应,则此盐酸的pH14-a(填“大于”“小于”或“等于”)。
[化学——选修有机化学基础](15分)
如下图所示,A、B、C、D、E、F、G均为有机物,它们之间有如下转化关系(部分产物和反应条件已略去)。已知B分子中含有苯环,其蒸气密度是同温同压下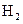 密度的59倍,
密度的59倍,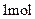 B最多可以和
B最多可以和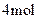
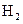 发生加成反应,B的苯环上的一个氢原子被硝基取代所得的产物有三种。E和G都能够发生银镜反应。F分子中含有羟基和羧基,在一定条件下可以聚合生成高分子化合物。
发生加成反应,B的苯环上的一个氢原子被硝基取代所得的产物有三种。E和G都能够发生银镜反应。F分子中含有羟基和羧基,在一定条件下可以聚合生成高分子化合物。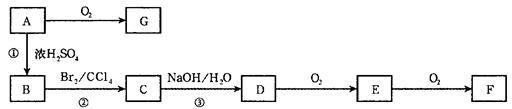
请回答下列问题:
(1)(各2分)A、B、C的结构简式:A为;B为;C为。
(2)(各1分)反应①的反应类型是;反应②的反应类型是;反应③的反应类型是。
(3)(2分)G与银氨溶液反应的化学方程式为。
(4)(2分)等物质的量的A与F发生酯化反应,所生成有机物的结构简式为。
(5)(2分)A的一种同分异构体与浓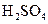 共热,也生成B和水,该同分异构体的结构简式为。
共热,也生成B和水,该同分异构体的结构简式为。
[化学——选修物质结构与性质](15分)
原子序数依次增大A、B、C、D、E、F(A、B、C、D、E、F分别代表元素符号)六种短周期元素。元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,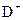 比
比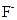 少一个电子层,E所在周期的各元素单质沸点变化如下图(元素按原子序数递增顺序连续排列),B、C两种元素分别能与A形成等电子的
少一个电子层,E所在周期的各元素单质沸点变化如下图(元素按原子序数递增顺序连续排列),B、C两种元素分别能与A形成等电子的 甲、乙两种分子,且两种
甲、乙两种分子,且两种
分子中各原子的个数见下表:
| 化合物 |
甲 |
乙 |
| 原子个数比 |
B:A=1:4 |
C:A=1:3 |
(1)元素F的基态原子的电子排布式为。
(2)分子甲的空间构型为,该分子中B的
原子轨道发生的是杂化。
(3)E单质属于晶体,E与A元素形成分子(填“极性”或“非极性”)
(4)D在F中燃烧的产物属于晶体,其晶体中与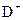 最近且等距离的
最近且等距离的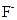 有个。
有个。
(5)C元素的第一电离能(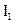 )氧元素的第一电离能(
)氧元素的第一电离能( )(填“<”或“>”或“=”)。
)(填“<”或“>”或“=”)。