氯普鲁卡因盐酸盐是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下: 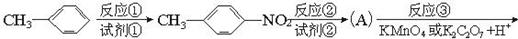
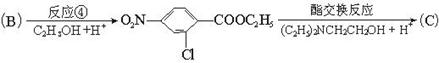
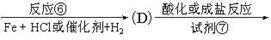

请把相应反应名称填入下表中,供选择的反应名称如下:
氯化、还原、硝化、磺化、氯代、酸化、碱化、成盐、酯化、酯交换、水解
| 反应编号 |
① |
② |
③ |
④ |
⑥ |
| 反应名称 |
|
|
|
|
|
用“>”或“<”回答下列问题:
(1)气态氢化物的稳定性:H2OH2S
(2)原子半径:MgNa
(3)碱性:NaOHMg(OH)2
分析下列实例,根据已有的知识和经验填写影响反应速率的因素:
(1)夏天食物易变质:。
(2)氯酸钾与二氧化锰混合共热可快速产生氧气:。
(3)粉状的碳酸钙与盐酸反应比块状的碳酸钙反应快:。
(4)硫在氧气中比在空气中燃烧快:。
(12分)有下列元素:Na,Cu,He,K,F。其中
(1)属于短周期主族元素的是________、。
(2)属于长周期主族元素的是________。
(3)属于非金属主族元素的是________。
(4)属于0族元素的是________。
(5)属于副族元素的是。
I.在容积为2.0L,的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如下图,据图同答下列问题: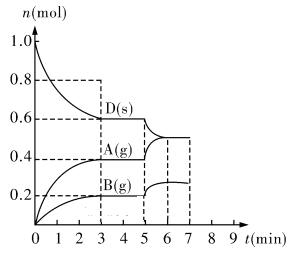
(1)从反应开始到第一次达到平衡时,A物质的平均反应速率为____________________。
(2)根据上图写出该反应的化学方程式_______________________________________,该反应的平衡常数K=_________________。
(3)第5 min时,升高温度,A、B、D的物质的量变化如上图,则降温,该反应的平衡常数_______(填“增大”、“减小”或“不变”)。
Ⅱ.可逆反应:①X(g)+2Y(g) 2Z(g)、②2M(g)
2Z(g)、②2M(g) N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
请同答下列问题:
(1)达平衡(I)时,X的转化率为___________________。
(2) X(g)+2Y(g) 2Z(g)是_________(填“吸”或“放”)热反应。
2Z(g)是_________(填“吸”或“放”)热反应。
钨是重要的战略元素,钨可以制造枪械、火箭推进器的喷嘴、切削金属,是一种用途较广的金属。工业上从经过预处理的钨矿原料(主要成分是FeWO4、MnWO4还含有Si、P、As的化合物等)制备WO4,然后通过煅烧还原三氧化钨生产钨粉。其中生产WO3的流程如下:同答下列问题:
(1)上述流程中,操作甲的名称是_____________________________________________。
(2)pH=10的溶液中含有的杂质阴离子有SiO32-、HAsO32-、HAsO42-、HPO42-等。加入H2O2的目的是_______,其离子方程式为:___________________________________________。
(3)钨矿原料“碱分解”时的浸出率与原料中的CaO含量、NaOH浓度、碱用量等都有关系,如下表所示。钨矿原料碱分解时的浸出率受NaOH浓度等因素影响的关系表
注:碱用量的单位为理论量的倍数
下列说法正确的是
| A.增大NaOH浓度,浸出率增大 | B.增大碱用量,浸出率一定增大 |
| C.增大碱用量,浸出率一定减小 | D.原料中CaO的含量增大,则浸出率增大 |
(4)在“净化”阶段,加入MgCl2的目的是使混合溶液中的其余酸根离子沉淀下来。此时尽量使溶液pH=10,以免产生Mg(OH)2沉淀,溶液中c(Mg2+ )应不超过_______(Ksp[Mg(OH)2]=5.6×10-12)。