将还原性铁粉分别放入冷的浓H2SO4 、浓HNO3 中,开始都有大量气泡生成,后来反应不再发生。已知生成的气体有刺激性气味,H2SO4 中生成的气体呈无色,HNO 3 中生成的气体呈红棕色;剩余的固体经检验有磁性。试回答:
(1)Fe的氧化产物是________。(写化学式,下同)
(2)浓H2 SO4 的还原产物是________,浓HNO3 的还原产物是________。
现有失去标签的氯化钙,硝酸银,盐酸,碳酸钠四种无色溶液,为了确定四种溶液各是什么,将它们随意编号上A.B.C.D后,,产生的现象如下表所示:
| 实验顺序 |
实验内容 |
实验现象 |
| (1) |
A+B |
没有现象发生 |
| (2) |
B+D |
有气体放出 |
| (3) |
B+C |
有沉淀生成 |
| (4) |
A+D |
有沉淀生成 |
根据实验现象按要求回答:
(1)写出A.B.C.D溶液中溶质的化学式:
A______ B_______ C_____ D______
(2)写出上述实验中有关反应的离子方程式
实验(2)__________________
实验(3)__________________
(13分)(1)下列物质能导电的是________,属于电解质的是________(填序号)。
①NaCl晶体 ②液态SO2 ③液态醋酸 ④汞
⑤BaSO4固体 ⑥纯蔗糖(C12H22O11) ⑦氨水 ⑧熔化的KNO3
(2)按要求写出下列方程式:
KHSO4熔融状态电离方程式:______________。
(3)已知砒霜As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4===2AsH3↑+6ZnSO4+3H2O
①请用双线桥法标出电子转移的方向和数目。_____________。
②As2O3在上述反应中显示出来的性质是_____________。
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
③该反应的氧化产物是________。
④若生成0.2 mol AsH3,则转移的电子数为_______________。
(4)当溶液中X2O72-与SO32-数目之比为1∶3时正好完全发生氧化还原反应,X在还原产物中的化合价为________。
(8分)有甲、乙、丙、丁四种液体,它们分别为Fe(OH)3胶体、硅酸胶体、As2S3胶体、NaOH溶液。现将有关实验现象记录如下:
(1)电泳:甲液体的阳极(即接电源正极的一极)周围颜色变浅,阴极(即接电源负极的一极)周围颜色变深;
(2)将一束光通过乙液体,无丁达尔现象;
(3)将乙慢慢加入到丙液体中,先出现凝聚,后液体变澄清。
则甲为________,乙为________,丙为________,丁为________。
(10分)已知某“84消毒液”瓶体部分标签如下所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
84消毒液
【有效成分】 NaClO
【规格】 1000 mL
【质量分数】 25%
【密度】 1.19 g·cm-3
(1)该“84消毒液”的物质的量浓度约为________mol·L-1(小数点后保留一位)。
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=________ mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是______(填序号)。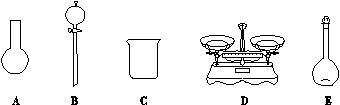
| A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器 |
| B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制 |
| C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低 |
| D.需要称量NaClO固体的质量为143.0 g |
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制2 000 mL 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中, H+的物质的量浓度为________mol·L-1。
②需用浓硫酸的体积为________mL。
如图所示3套实验装置,分别回答下列问题:


(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入KSCN溶液呈无色,再滴入氯水即可观察到铁钉附近的溶液变红色,表明铁被_______;向插入碳棒的玻璃筒内滴入酚酞试液,可观察到碳棒附近的溶液变红,该电极反应为_______________。
(2)装置2中的石墨是_________极(填“正”或“负”),该装置发生的总反应的离子方程式为__________。
(3)装置3中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞试液,观察到石墨电极附近首先变红。
①电源的M端为_________极,甲烧杯中铁电极的电极反应为________________;
②乙烧杯中电解反应的离子方程式为______________;
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64 g,则甲烧杯中产生的气体在标准状况下为________ mL。