(16 分)目前,消除氮氧化物污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4 (g)+4NO2 (g)=4NO(g)+CO2 (g)+2H2 O(g) ΔH=-574 kJ·mol-1
②CH4 (g)+4NO(g)=2N2 (g)+CO2 (g)+2H2 O(g) ΔH=-1160 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式__________
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2 (g)+CO2 (g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温条件下反应,反应进行到不同时间测得各物质的浓度如下
N2 (g)+CO2 (g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温条件下反应,反应进行到不同时间测得各物质的浓度如下
| 浓度/mol·L-1 时间/min |
NO |
N2 |
CO2 |
| 0 |
0.100 |
0 |
0 |
| 10 |
0.058 |
0.021 |
0.021 |
| 20 |
0.040 |
0.030 |
0.030 |
| 30 |
0.040 |
0.030 |
0.030 |
| 40 |
0.032 |
0.034 |
0.017 |
| 50 |
0.032 |
0.034 |
0.017 |
①不能作为判断反应达到化学平衡状态的依据是_______
A.容器内CO2的浓度保持不变
B.v正(N2)="2" v正(NO)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
②在该温度下时.该反应的平衡常数为 (保留两位小数);
③在30 min,改变某一条件,反应重新达到平衡,则改变的条件是_______。
(3)合成塔失去活性的铬锌触媒可用于制备锌锰电池。在碱性条件下,该电池的总反应为:Zn(s) +2MnO2 (s) +H2O(l) = Zn(OH)2 (s) +Mn2O3(s) ,该电池正极的电极反应式是 。PbO2可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生反应的电极反应式为 ,阴极上观察到的现象是;
若电解液中不加入Cu(NO3)2这样做的主要缺点是 。
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等, A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子。
请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关):
(1) A~F六种元素原子,原子半径最大的是 (填序号)。
(2)A、C、D三种元素组成的一种常见化合物,是重要的工业产品,该化合物电子式为: 。
(3)B与F两种元素形成的一种化合物分子,各原子均达八电子结构,其中B显负价,F显正价,则该化合物水解的主要产物是: 。
(4)A、C、E三种元素形成的一种常见化合物,其浓溶液在加热条件下可与铜反应,该反应的化学方程式为: 。
A、B、C、D分别代表四种不同的元素。A原子的最外层电子排布为ns1,B原子的价电子排布为ns2np2,C原子的最外层电子数是其电子层数的3倍,D原子的L电子层的p轨道有3个电子。
(1)C原子的电子排布式为 ,若A原子的最外层电子排布为1s1,则按原子轨道的重迭方式判断,A与C形成的化合物中的共价键类型属于 ,A与C所形成的化合物的熔沸点明显高于A与C的同主族元素所形成的化合物的熔沸点,其原因是 。
(2)当n=2时,B原子的结构示意图为 ,B与C形成的晶体属于晶体。当n=3时,B与C形成的晶体中,B原子的杂化方式为 ,该晶体中最小的环共有 个微粒构成,微粒间的作用力是 。
(3)若A原子的最外层电子排布为4s1,B原子的价电排布为3s23p2,A在元素周期表中的位置是 ,A、B、C、D四种元素的第一电离能由大到小的顺序是
(用元素符号表示)。
B.(实验化学,12分)某化学研究性学习小组进行了一系列“带火星的木炭复燃”的实验,实验装置如下图所示。
(1)甲组同学探究“使带火星木炭复燃时O2的体积分数的极限”。将氧气和空气(假定空气中O2的体积分数为20%)按不同的体积比混合得100mL气体A进行实验,实验记录如下:
| 编号 |
I |
II |
III |
IV |
V |
| V(O2)/mL |
60 |
40 |
20 |
12 |
10 |
| V(空气)/mL |
40 |
60 |
80 |
88 |
90 |
| 现象 |
木炭复燃 |
木炭复燃 |
木炭复燃 |
木炭有时燃烧,有时不燃烧 |
木炭 不复燃 |
回答下列问题:
①使带火星木炭复燃的O2的体积分数最小约为 。
②用带火星木炭检验集气瓶里是否集满O2,若木炭复燃,能否认为集气瓶里的气体一定是纯净的O2?答: (填“能”或“否”)。
③若按照3∶2的比例混合O2和CO2气体,该混合气体能否使带火星的木炭复燃?
答: (“能”、“否”或“不一定”)。
(2)乙组同学探究“NO2能否支持燃烧”的问题,设计了如下几组实验,实验记录及结论如下:
| 编号 |
制取气体A(下列反应产生的混合气体) |
B中的现象 |
结论 |
| a |
在烧瓶中加热适量浓HNO3 4HNO3△4NO2↑+O2↑+2H2O↑ |
充满红棕色气体,木炭不复燃,火星熄灭 |
NO2不支持燃烧 |
| b |
加热AgNO3固体 2AgNO3△2NO2↑+O2↑+2Ag |
充满红棕色气体,木炭复燃 |
NO2支持燃烧 |
| c |
加热Cu(NO3)2固体 2Cu(NO3)2△4NO2↑+O2↑+2CuO |
充满红棕色气体,木炭复燃 |
NO2支持燃烧 |
你认为a、b、c三个结论是否可靠?说出你的理由。
a. ,原因是 。
b. ,原因是 。
c. ,原因是 。
工业生产粗硅的主要原理为:SiO2+2C 3273K Si(粗)+2CO↑。
(1)若在制粗硅的过程中同时生成了碳化硅,且生成的硅和碳化硅的物质的量之比为5∶1,则参加反应的C和SiO2的质量比为 。
(2)工业上可通过如下流程由粗硅制取纯硅:
|
|||||
|
|
||||


 Si(粗)SiCl4(l) Si(纯)
Si(粗)SiCl4(l) Si(纯)
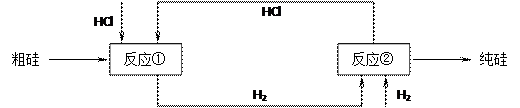
利用芳香烃X和链烃Y可以合成紫外线吸收剂BAD,BAD的结构简式为: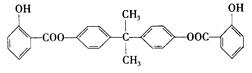
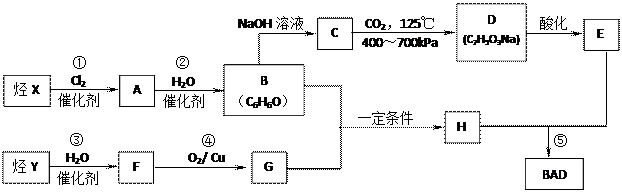
BAD的合成路线如下(已知G不能发生银镜反应):
试回答下列问题:
(1)写出结构简式:Y_________________;D______________________。
(2)属于取代反应的有_______________________(填数字序号)。
(3)1 mol BAD最多可与含__________mol NaOH的溶液完全反应。
(4)写出下列反应的化学方程式:
反应④: ________________________________;
B+G→ H:________________________________ 。
我国规定饮用水质量标准必须符合下列要求:
| pH |
6.5~8.5 |
| Ca2+、Mg2+总浓度 |
<0.0045mol·L-1 |
| 细菌总数 |
<100个/mL |
某综合实践活动小组到自来水厂进行参观,了解到源水处理成自来水的工艺流程示意
图如下: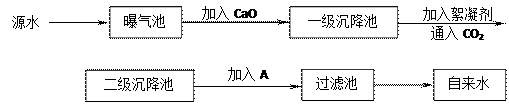
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入CaO后生成,进而发生若干个化学反应,请写出其中任意一个反应的离子方程式 。
(2)加入絮凝剂可以除去其中的悬浮固体颗粒,该过程是 (填写序号)。
①只有物理过程,无化学过程
②只有化学过程,无物理过程
③既有物理过程,又有化学过程
(3)FeSO4·7H2O是常用的絮凝剂,加入后最终生成红褐色胶状沉淀,则这种沉淀是 (填写化学式)。
(4)通入二氧化碳的目的是 和 。
(5)物质A的作用是 ,则A可以选择下列物质中的 (填写序号)。
①ClO2②SO2③液氯④Ca(ClO2)2⑤浓硫酸